Składniki aktywne: lewonorgestrel, etynyloestradiol
Miranova 0,1 mg + 0,02 mg tabletki powlekane
Dlaczego używa się Miranova? Po co to jest?
Miranova to złożony hormonalny środek antykoncepcyjny (COC) stosowany w celu zapobiegania ciąży.
Każda tabletka zawiera niewielką ilość dwóch różnych hormonów żeńskich, lewonorgestrelu i etynyloestradiolu (grupa farmakoterapeutyczna progestagenów i estrogenów).
Pigułki antykoncepcyjne zawierające dwa hormony nazywane są „tabletkami złożonymi”.
Przeciwwskazania Kiedy nie należy stosować preparatu Miranova
Nie należy przyjmować leku Miranova
- jeśli u pacjenta stwierdzono uczulenie na lewonorgestrel, etynyloestradiol lub którykolwiek z pozostałych składników tego leku, nie należy stosować leku Miranova, jeśli u pacjenta występuje którykolwiek z niżej wymienionych schorzeń, jeśli u pacjenta występuje którykolwiek z niżej wymienionych schorzeń, należy porozmawiać z lekarzem prowadzącym. omówi to z Tobą inne metody kontroli urodzeń, które mogą być dla Ciebie bardziej odpowiednie.
- jeśli masz (lub kiedykolwiek) zakrzep krwi w naczyniu nogi (zakrzepica żył głębokich, DVT), płuc (zator tętnicy płucnej, PE) lub innych narządach;
- jeśli wiesz, że masz zaburzenie, które wpływa na krzepliwość krwi, takie jak niedobór białka C, niedobór białka S, niedobór antytrombiny III, czynnik V Leiden lub przeciwciała antyfosfolipidowe;
- jeśli planujesz „operację” lub będziesz leżeć przez dłuższy czas (patrz rozdział „Zakrzepy krwi”);
- jeśli kiedykolwiek miałeś zawał serca lub udar;
- jeśli pacjent ma (lub kiedykolwiek miał) dusznicę bolesną (stan, który powoduje silny ból w klatce piersiowej i może być pierwszym objawem zawału serca) lub przemijający napad niedokrwienny (TIA – przejściowe objawy udaru);
- jeśli u pacjenta występuje którakolwiek z następujących chorób, które mogą zwiększać ryzyko powstania zakrzepów krwi w tętnicach: ciężka cukrzyca z uszkodzeniem naczyń krwionośnych, bardzo wysokie ciśnienie krwi, bardzo wysoki poziom tłuszczu (cholesterolu lub trójglicerydów) we krwi, choroba zwana hiperhomocysteinemią (duża ilość homocysteiny we krwi);
- jeśli masz (lub kiedykolwiek miałeś) rodzaj migreny zwany „migreną z aurą”;
- jeśli masz choroby naczyniowe oka;
- jeśli u pacjenta występuje lub kiedykolwiek występowała żółtaczka (zażółcenie skóry) lub ciężka choroba wątroby; w takim przypadku nie należy stosować leku Miranova, dopóki wartości czynności wątroby nie powrócą do normy;
- jeśli masz lub kiedykolwiek miałeś raka piersi lub narządów płciowych
- jeśli masz lub kiedykolwiek miałeś łagodny lub złośliwy rak wątroby;
- jeśli masz krwawienie z pochwy niewiadomego pochodzenia;
- jeśli jesteś lub podejrzewasz, że jesteś w ciąży;
- w skojarzeniu z rytonawirem (lek przeciwwirusowy).
Jeśli którykolwiek z tych stanów pojawi się po raz pierwszy podczas stosowania leku, należy natychmiast przerwać jego przyjmowanie i skonsultować się z lekarzem. W międzyczasie stosuj niehormonalne metody antykoncepcji. Zobacz także „Uwagi ogólne”.
Środki ostrożności dotyczące stosowania Informacje ważne przed przyjęciem leku Miranova
Przed rozpoczęciem przyjmowania leku Miranova należy omówić to z lekarzem lub farmaceutą.
Ogólne notatki
Przed rozpoczęciem stosowania leku Miranova należy zapoznać się z informacjami dotyczącymi zakrzepów krwi w części „Zakrzepy krwi”. Szczególnie ważne jest zapoznanie się z objawami zakrzepu krwi (patrz punkt „Zakrzepy krwi”).
Przed rozpoczęciem lub wznowieniem przyjmowania leku Miranova wskazane jest przeprowadzenie dokładnego badania lekarskiego i wykluczenie ciąży.Wskazane jest również przeprowadzanie okresowych badań kontrolnych, przynajmniej raz w roku, w trakcie stosowania leku. wizyty, zostaną ustalone przez lekarza i będą miały na celu w szczególności kontrolę ciśnienia krwi, badanie piersi, jamy brzusznej i ogólne badanie ginekologiczne, w tym badanie cytologiczne i względne badania krwi.
Jak wszystkie tabletki antykoncepcyjne, Miranova nie chroni przed zakażeniem wirusem HIV (AIDS) ani innymi chorobami przenoszonymi drogą płciową.
Miranova jest przepisywana do użytku osobistego i nie może być dostępna dla kilku osób jednocześnie.
Kiedy szczególnie uważać na Miranova
Kiedy powinieneś iść do lekarza?
Skontaktuj się z lekarzem w trybie pilnym
jeśli zauważysz możliwe objawy zakrzepu krwi, które mogą wskazywać, że cierpisz na zakrzep krwi w nodze (zakrzepica żył głębokich), zakrzep krwi w płucu (zator tętnicy płucnej), atak serca lub udar (patrz następny akapit „ Zakrzep krwi (zakrzepica)”).
Opis objawów tych poważnych działań niepożądanych znajduje się w rozdziale „Jak rozpoznać zakrzep krwi”.
W tej ulotce opisano niektóre sytuacje, w których konieczne jest przerwanie stosowania leku lub w których może nastąpić zmniejszenie skuteczności leku. W takich sytuacjach nie należy uprawiać seksu lub należy zastosować dodatkowe niehormonalne środki antykoncepcyjne, takie jak stosowanie prezerwatyw lub innych metod barierowych. w temperaturze i śluzie szyjkowym, które występują podczas cyklu miesiączkowego.
Jeśli u pacjenta występuje którykolwiek z niżej wymienionych stanów, stosowanie tabletki złożonej może wymagać ścisłego nadzoru lekarza.Przed rozpoczęciem stosowania leku Miranova należy ostrzec lekarza o którymkolwiek z niżej wymienionych stanów. Twój lekarz może zalecić inną (niehormonalną) metodę antykoncepcji.
Należy poinformować lekarza, jeśli którakolwiek z poniższych sytuacji dotyczy Ciebie. Jeśli ten stan pojawi się lub pogorszy podczas stosowania leku Miranova, należy poinformować o tym lekarza.
- palić;
- cukrzyca;
- nadwaga;
- podwyższone ciśnienie krwi (nadciśnienie);
- wady zastawek serca lub niektóre zaburzenia rytmu serca;
- powierzchowne zapalenie żył (zapalenie żył);
- żylaki;
- historia zakrzepicy, zawału serca lub udaru mózgu (w tym u bliskich członków rodziny);
- migrena (jednostronny ból głowy);
- depresja;
- padaczka (patrz „Inne leki i Miranova”);
- historia wysokiego poziomu cholesterolu i trójglicerydów (tłuszczów) we krwi (w tym u członków najbliższej rodziny);
- guzki piersi;
- rodzinna historia raka piersi;
- choroba wątroby lub pęcherzyka żółciowego;
- porfiria (zaburzenia metaboliczne krwi);
- jeśli u pacjenta występuje obecnie lub w przeszłości ostuda (żółto-brązowe plamy na skórze, zwłaszcza na twarzy). W takim przypadku unikaj długotrwałej ekspozycji na słońce lub promienie ultrafioletowe;
- jeśli u pacjentki wystąpiła opryszczka ciężarnych (autoimmunologiczna choroba skóry występująca u kobiet w ciąży lub bezpośrednio po porodzie);
- niektóre stany patologiczne charakteryzujące się opornością na aktywowane białko C, hiperhomocysteinemią, niedoborem antytrombiny III, niedoborem białka C, niedoborem białka S, przeciwciałami antyfosfolipidowymi (przeciwciała antykardiolipinowe, antykoagulant toczniowy), które predysponują do wystąpienia zakrzepicy żylnej lub tętniczej;
- pląsawica Sydenhama (choroba ośrodkowego układu nerwowego);
- utrata słuchu spowodowana otosklerozą.
- jeśli u pacjenta występuje dziedziczny obrzęk naczynioruchowy, leki zawierające estrogeny mogą wywoływać lub nasilać objawy obrzęku naczynioruchowego. natychmiast powiadomić lekarza.
- jeśli u pacjenta występuje choroba Leśniowskiego-Crohna lub wrzodziejące zapalenie jelita grubego (przewlekła choroba zapalna jelit);
- jeśli u pacjenta występuje toczeń rumieniowaty układowy (SLE, choroba, która atakuje naturalny system obronny);
- jeśli u pacjenta występuje zespół hemolityczno-mocznicowy (HUS, zaburzenie krzepnięcia krwi powodujące zaburzenia czynności nerek);
- jeśli u pacjenta występuje niedokrwistość sierpowatokrwinkowa (dziedziczna choroba krwinek czerwonych);
- jeśli u pacjenta występuje wysoki poziom tłuszczu we krwi (hipertriglicerydemia) lub „dodatni wywiad rodzinny dotyczący tej choroby”. Hipertriglicerydemia jest związana ze zwiększonym ryzykiem rozwoju zapalenia trzustki;
- jeśli planujesz „operację” lub będziesz leżeć przez dłuższy czas (patrz rozdział „Zakrzepy krwi”);
- jeśli właśnie urodziłaś, ryzyko powstania zakrzepów krwi jest wyższe. Zapytaj swojego lekarza, jak długo po urodzeniu dziecka możesz rozpocząć przyjmowanie leku Miranova;
- jeśli masz „zapalenie żył pod skórą (zakrzepowe zapalenie żył powierzchownych);
- jeśli masz żylaki.
W przypadku pierwszego pojawienia się, nawrotu lub pogorszenia któregokolwiek z powyższych stanów podczas stosowania pigułki należy skonsultować się z lekarzem.
Nie należy przyjmować preparatów z dziurawca zwyczajnego (Hypericum perforatum) jednocześnie z lekami zawierającymi doustne środki antykoncepcyjne, digoksynę, teofilinę, karbamazepinę, fenobarbital, fenytoinę ze względu na ryzyko obniżenia stężenia we krwi i zmniejszonej skuteczności terapeutycznej doustnych środków antykoncepcyjnych, digoksyny, teofiliny, karbamazepiny, fenobarbital, fenytoina (patrz „Inne leki i Miranova”).
ZAKRZEPY
Stosowanie złożonych hormonalnych środków antykoncepcyjnych, takich jak Miranova, zwiększa ryzyko powstania zakrzepów krwi w porównaniu z ich nieużywaniem. W rzadkich przypadkach zakrzep krwi może blokować naczynia krwionośne i powodować poważne problemy. Mogą powstać zakrzepy krwi.
- w żyłach (tzw. „zakrzepica żylna”, „żylna choroba zakrzepowo-zatorowa” lub VTE)
- w tętnicach (określanych jako „zakrzepica tętnicza”, „tętnicza choroba zakrzepowo-zatorowa” lub ATE).
Uzdrowienie ze skrzepów krwi nie zawsze jest kompletne. Rzadko mogą wystąpić długotrwałe, poważne skutki lub bardzo rzadko mogą być śmiertelne.
Należy pamiętać, że ogólne ryzyko powstania szkodliwego zakrzepu krwi związanego z preparatem Miranova jest niskie.
JAK ROZPOZNAĆ ZAKRZECH KRWI?
Natychmiast skontaktuj się z lekarzem, jeśli zauważysz którykolwiek z poniższych objawów.
- ból lub tkliwość w nodze, która może być odczuwana tylko podczas stania lub chodzenia
- zwiększone czucie ciepła w chorej nodze
- zmiana koloru skóry na nodze, np. bladość, zaczerwienienie lub zasinienie.
- duszność lub nagły, niewyjaśniony szybki oddech;
- nagły kaszel bez wyraźnej przyczyny, prawdopodobnie powodujący wydzielanie krwi;
- ostry ból w klatce piersiowej, który może nasilać się przy głębokim oddychaniu;
- silne zawroty głowy lub zawroty głowy;
- szybkie lub nieregularne bicie serca;
- silny ból w żołądku
- natychmiastowa utrata wzroku lub
- bezbolesne niewyraźne widzenie, które może prowadzić do utraty wzroku
- ból w klatce piersiowej, dyskomfort, uczucie ucisku lub ciężkości;
- uczucie ściskania lub pełności w klatce piersiowej, ramieniu lub poniżej mostka;
- uczucie pełności, niestrawności lub zadławienia;
- dyskomfort w górnej części ciała promieniujący do pleców, szczęki, gardła, ramion i żołądka;
- pocenie się, nudności, wymioty lub zawroty głowy;
- skrajne osłabienie, niepokój lub duszność;
- szybkie lub nieregularne bicie serca.
- nagłe drętwienie lub osłabienie twarzy, ręki lub nogi, zwłaszcza po jednej stronie ciała;
- nagłe splątanie, trudności w mówieniu lub rozumieniu;
- nagła trudność widzenia w jednym lub obu oczach;
- nagłe trudności w chodzeniu, zawroty głowy, utrata równowagi lub koordynacji;
- nagła, ciężka lub przedłużająca się migrena bez znanej przyczyny
- utrata przytomności lub omdlenia z drgawkami lub bez drgawek.
- obrzęk i bladoniebieskie przebarwienie jednej kończyny;
- silny ból brzucha (ostry brzuch).
ZAKRZEPY KRWI W ŻYLE
Co może się stać, jeśli w żyle powstanie zakrzep krwi?
Stosowanie złożonych hormonalnych środków antykoncepcyjnych wiąże się ze zwiększonym ryzykiem powstawania zakrzepów krwi w żyłach (zakrzepica żylna).Jednak te działania niepożądane występują rzadko.W większości przypadków występują w pierwszym roku stosowania złożonego hormonalnego środka antykoncepcyjnego. .
Jeśli w żyle nogi lub stopy utworzy się zakrzep krwi, może to spowodować zakrzepicę żył głębokich (DVT).
Jeśli skrzep krwi przemieści się z nogi i ulokuje się w płucu, może spowodować „zator tętnicy płucnej”.
Bardzo rzadko zakrzep może powstać w innym narządzie, takim jak oko (zakrzepica żył siatkówki).
Kiedy ryzyko powstania zakrzepu krwi w żyle jest największe?
Ryzyko powstania zakrzepu krwi w żyle jest największe w pierwszym roku stosowania złożonego hormonalnego środka antykoncepcyjnego po raz pierwszy. Ryzyko może być jeszcze większe, jeśli wznowisz przyjmowanie złożonych hormonalnych środków antykoncepcyjnych (tego samego lub innego leku) po przerwie trwającej 4 tygodnie lub więcej.
Po pierwszym roku ryzyko jest zmniejszone, ale zawsze jest nieco wyższe niż w przypadku, gdy nie stosowałaś złożonych hormonalnych środków antykoncepcyjnych.
Po zaprzestaniu przyjmowania leku Miranova ryzyko powstania zakrzepów krwi wraca do normy w ciągu kilku tygodni.
Jakie jest ryzyko powstania zakrzepów krwi?
Ryzyko zależy od naturalnego ryzyka wystąpienia ŻChZZ i rodzaju przyjmowanego złożonego hormonalnego środka antykoncepcyjnego.
Ogólne ryzyko powstania zakrzepów krwi w nogach lub płucach (ZŻG lub ZP) po zastosowaniu preparatu Miranova jest niskie.
- Na 10 000 kobiet, które nie stosują złożonych hormonalnych środków antykoncepcyjnych i nie są w ciąży, u około 2 w ciągu roku powstanie zakrzep krwi.
- Na 10 000 kobiet stosujących złożone hormonalne środki antykoncepcyjne zawierające lewonorgestrel, noretysteron lub norgestymat, takie jak Miranova, w ciągu roku u około 5-7 wystąpi zakrzep krwi.
- Ryzyko powstania zakrzepu krwi zależy od historii choroby (patrz „Czynniki zwiększające ryzyko powstania zakrzepu krwi”).
Czynniki zwiększające ryzyko powstania zakrzepów krwi w żyle Ryzyko powstania zakrzepów krwi podczas stosowania preparatu Miranova jest niskie, ale niektóre stany zwiększają to ryzyko. Jego ryzyko jest większe:
- jeśli masz znaczną nadwagę (wskaźnik masy ciała lub BMI powyżej 30 kg/m2);
- jeśli członek Twojej najbliższej rodziny miał zakrzep krwi w nodze, płucu lub innym narządzie w młodym wieku (poniżej około 50 lat). W takim przypadku możesz mieć dziedziczne zaburzenie krzepnięcia krwi;
- w przypadku planowanego zabiegu chirurgicznego lub konieczności długiego leżenia z powodu urazu lub choroby, lub jeśli pacjent ma nogę w gipsie.Może być konieczne przerwanie stosowania leku Miranova na kilka tygodni przed zabiegiem lub w trakcie okres zmniejszenia mobilności.
- z wiekiem (szczególnie powyżej 35 roku życia);
- jeśli urodziłaś mniej niż kilka tygodni temu.
Ryzyko powstania zakrzepów krwi wzrasta, im więcej masz warunków. Podróż samolotem (dłuższa niż 4 godziny) może tymczasowo zwiększyć ryzyko powstania zakrzepów krwi, zwłaszcza jeśli masz inne wymienione czynniki ryzyka. Ważne jest, aby poinformować lekarza, jeśli którekolwiek z powyższych dotyczy Ciebie, nawet jeśli nie masz pewności. Lekarz może zdecydować o zaprzestaniu stosowania leku Miranova.Jeśli którykolwiek z powyższych stanów ulegnie zmianie podczas stosowania leku Miranova, na przykład jeśli u bliskiego krewnego wystąpi zakrzepica bez znanej przyczyny lub jeśli pacjent przytyje, należy skontaktować się z lekarzem. .
ZAKRZEPY KRWI W TĘTNICY
Co może się stać, jeśli w „tętnicy” utworzy się skrzep krwi?
Podobnie jak zakrzepy krwi w żyle, zakrzepy w tętnicy mogą powodować poważne problemy, na przykład mogą powodować zawał serca lub udar.
Czynniki zwiększające ryzyko powstania zakrzepów krwi w tętnicy
Należy zauważyć, że ryzyko zawału serca lub udaru związanego ze stosowaniem preparatu Miranova jest bardzo niskie, ale może wzrosnąć:
- z wiekiem (powyżej 35 lat);
- jeśli palisz. Podczas stosowania złożonych hormonalnych środków antykoncepcyjnych, takich jak Miranova, zaleca się rzucenie palenia. Jeśli nie możesz rzucić palenia i masz więcej niż 35 lat, lekarz może zalecić stosowanie innego rodzaju środka antykoncepcyjnego;
- jeśli masz nadwagę;
- jeśli masz wysokie ciśnienie krwi;
- jeśli członek Twojej najbliższej rodziny miał zawał serca lub udar w młodym wieku (mniej niż około 50 lat). W takim przypadku możesz również być narażony na wysokie ryzyko zawału serca lub udaru mózgu;
- jeśli u pacjenta lub bliskiego krewnego występuje wysoki poziom tłuszczów we krwi (cholesterolu lub trójglicerydów);
- jeśli cierpisz na migreny, zwłaszcza migreny z aurą;
- jeśli u pacjenta występują problemy z sercem (wada zastawki, zaburzenie rytmu serca zwane migotaniem przedsionków);
- jeśli masz cukrzycę.
Jeśli masz więcej niż jeden z tych stanów lub jeśli którykolwiek z nich jest szczególnie ciężki, ryzyko powstania zakrzepu krwi może być jeszcze wyższe.
Jeśli którykolwiek z powyższych stanów ulegnie zmianie podczas stosowania leku Miranova, na przykład, jeśli zaczniesz palić, jeśli bliski krewny ma zakrzepicę bez znanej przyczyny lub jeśli znacznie przytyjesz, skontaktuj się z lekarzem.
Guzy
Rozpoznanie raka piersi jest nieco częstsze u kobiet stosujących pigułkę niż u kobiet w tym samym wieku, które tego nie robią. Niewielki wzrost liczby rozpoznań raka piersi stopniowo zanika w ciągu 10 lat od przerwania leczenia. Nie wiadomo, czy różnica wynika z pigułki. Wzrost ten może wynikać z wcześniejszej diagnozy, ponieważ kobiety są częściej widywane, biologicznego wpływu pigułki lub obu tych czynników. Rak piersi zdiagnozowany u kobiet przyjmujących pigułkę jest zwykle mniej zaawansowany klinicznie niż rak piersi. U kobiet przyjmujących pigułkę antykoncepcyjną zgłaszano łagodne guzy wątroby, a jeszcze rzadziej złośliwe guzy wątroby, które mogą powodować krwawienie wewnętrzne. Donoszono, że rak szyjki macicy (szyjki macicy) występuje częściej u kobiet stosujących tabletki przez długi czas.
Kontrole okresowe
Podczas zażywania pigułki lekarz zaprosi Cię na okresowe kontrole, zwykle co roku.
Jak najszybciej skontaktuj się z lekarzem:
- jeśli zauważysz jakiekolwiek zmiany w swoim stanie zdrowia, szczególnie te opisane w tej ulotce (patrz także „Nie stosować leku Miranova” oraz „Ostrzeżenia i środki ostrożności”. Nie zapomnij o odniesieniach do bliskich członków rodziny);
- jeśli czujesz guzek w piersi;
- jeśli konieczne jest stosowanie innych leków (patrz także „Inne leki i Miranova”);
- jeśli jesteś unieruchomiony lub musisz poddać się operacji (skonsultuj się z lekarzem co najmniej cztery tygodnie wcześniej);
- jeśli masz ciężkie i nietypowe krwawienie z pochwy;
- jeśli zapomniałeś zażyć tabletki w pierwszym tygodniu stosowania i uprawiałeś seks w ciągu siedmiu dni poprzedzających zapomnienie;
- jeśli nie masz miesiączki przez dwa kolejne cykle lub jeśli podejrzewasz ciążę, nie rozpoczynaj nowego opakowania bez zgody lekarza.
Należy przerwać przyjmowanie tabletek i natychmiast skonsultować się z lekarzem, jeśli zauważysz możliwe objawy zakrzepicy:
- kaszel, który zaczyna się nagle;
- silny ból w klatce piersiowej, który może promieniować do lewego ramienia;
- nagła duszność;
- nietypowy, silny, przedłużający się ból głowy lub napad migreny;
- częściowa lub całkowita utrata wzroku lub podwójne widzenie;
- niewyraźna mowa lub niemożność mówienia;
- nagłe zmiany słuchu, zapachu i smaku;
- zawroty głowy lub omdlenia;
- osłabienie lub drętwienie jakiejkolwiek części ciała;
- silny ból brzucha;
- silny ból lub obrzęk jednej nogi.
Powyższe sytuacje i objawy są zilustrowane i wyjaśnione bardziej szczegółowo w innych częściach tej ulotki.
Dzieci i młodzież
Nie ustalono bezpieczeństwa i skuteczności stosowania preparatu Miranova u dzieci i młodzieży w wieku poniżej 18 lat Brak dostępnych danych.
Pacjenci z zaburzeniami czynności wątroby (wątroby)
Nie należy przyjmować leku Miranova, jeśli u pacjenta występuje choroba wątroby. Zobacz „Nie używać Miranova” i „Ostrzeżenia i środki ostrożności”.
Pacjenci z zaburzeniami czynności nerek (nerek)
Preparat Miranova nie był specjalnie badany u pacjentów z zaburzeniami czynności nerek.
Interakcje Jakie leki lub pokarmy mogą zmienić działanie Miranova
Należy powiedzieć lekarzowi lub farmaceucie, jeśli pacjent przyjmuje, ostatnio przyjmował lub może przyjmować jakiekolwiek inne leki.
Niektóre leki mogą uniemożliwić skuteczne działanie pigułki, na przykład:
- prymidon, fenytoina, barbiturany, karbamazepina, oksykarbamazepina, topiramat, felbamat (stosowane w leczeniu padaczki),
- ryfampicyna i ryfabutyna (stosowane w leczeniu gruźlicy),
- rytonawir, newirapina (stosowane w leczeniu zakażeń HIV i wirusowego zapalenia wątroby typu C),
- modafinil (stosowany w leczeniu nadmiernej senności związanej z narkolepsją) i flunaryzyna,
- gryzeofulwina i leki przeciwgrzybicze z grupy azoli, takie jak itrakonazol, worykonazol, flukonazol (stosowane w leczeniu zakażeń grzybiczych),
- antybiotyki makrolidowe, takie jak klarytromycyna, erytromycyna (stosowane w leczeniu zakażeń bakteryjnych),
- blokery kanału wapniowego, takie jak werapamil i diltizem (stosowane w leczeniu niektórych chorób serca i wysokiego ciśnienia krwi),
- etorykoksyb (stosowany w leczeniu zapalenia stawów, choroby zwyrodnieniowej stawów).
Miranova może zakłócać działanie niektórych innych leków, takich jak:
- leki zawierające cyklosporynę (stosowane w zapobieganiu reakcji odrzucania przeszczepu),
- lamotrygina (stosowana w leczeniu padaczki),
- melatonina (hormon)
- midazolam (uspokajający),
- teofilina (stosowana do poszerzania dróg oddechowych),
- tyzanidyna (stosowana do rozszerzania mięśni).
Nie należy przyjmować preparatów zawierających ziele dziurawca Hypericum perforatum jednocześnie z doustnymi środkami antykoncepcyjnymi, ponieważ może to spowodować utratę skuteczności antykoncepcji Zgłaszano przypadki niechcianych ciąży i wznowienia miesiączki.Wynika to z indukcji enzymów odpowiedzialnych za metabolizm produktów leczniczych przez preparaty na bazie Hypericum perforatum Efekt indukcji może utrzymywać się przez co najmniej 2 tygodnie po zaprzestaniu leczenia produktami na bazie Hypericum perforatum (patrz „ Miranova z jedzeniem i piciem ").
Troleandomycyna (antybiotyk makrolidowy) może zwiększać ryzyko cholestazy wewnątrzwątrobowej (niezdolność przepływu żółci z wątroby do dwunastnicy) przy jednoczesnym podawaniu z doustnymi środkami antykoncepcyjnymi.
Zawsze informuj lekarza przepisującego pigułkę o lekach, które już przyjmujesz, a także innym lekarzom lub dentystom przepisującym inne leki o stosowaniu leku Miranova, aby mogli ustalić, czy i na jak długo jest ona potrzebna. metody.
Stosowanie pigułki może wpływać na wyniki niektórych badań krwi, ale zmiany te zwykle mieszczą się w normalnym zakresie. Dlatego wskazane jest poinformowanie lekarza, który zlecił wykonanie badań, że przyjmujesz pigułkę.
Miranova z jedzeniem i piciem
Nie należy przyjmować leku Miranova z sokiem grejpfrutowym.
Podczas przyjmowania doustnych środków antykoncepcyjnych nie należy przyjmować preparatów Hypericum perforatum, ponieważ ich jednoczesne przyjmowanie może prowadzić do utraty skuteczności antykoncepcji (patrz „Inne leki i Miranova”).
Ostrzeżenia Ważne jest, aby wiedzieć, że:
Ciąża i karmienie piersią
Jeśli pacjentka jest w ciąży lub karmi piersią, podejrzewa, że może być w ciąży lub planuje mieć dziecko, przed zastosowaniem tego leku należy poradzić się lekarza lub farmaceuty.
Nie należy stosować leku Miranova, jeśli pacjentka jest w ciąży lub podejrzewa, że jest w ciąży. W przypadku zajścia w ciążę podczas stosowania leku Miranova należy natychmiast przerwać stosowanie leku.
Nie zaleca się stosowania preparatu Miranova w okresie karmienia piersią.Niewielkie ilości sterydów antykoncepcyjnych i (lub) ich metabolitów mogą przenikać do mleka matki, co może mieć wpływ na dziecko.
Prowadzenie i używanie maszyn
Miranova nie ma wpływu lub ma nieistotny wpływ na zdolność prowadzenia pojazdów i obsługiwania maszyn.
Miranova zawiera laktozę i sacharozę
Ten produkt leczniczy zawiera laktozę i sacharozę. Jeśli lekarz poinformował pacjenta, że ma „nietolerancję niektórych cukrów”, przed przyjęciem tego produktu leczniczego należy skontaktować się z lekarzem.
Dawkowanie i sposób użycia Jak stosować Miranova: Dawkowanie
Ten lek należy zawsze stosować zgodnie z zaleceniami lekarza lub farmaceuty. W razie wątpliwości skonsultuj się z lekarzem lub farmaceutą. Opakowanie Miranova zawiera 21 tabletek, wszystkie oznaczone dniem tygodnia, w którym należy przyjąć każdą z nich. Tabletkę należy przyjmować codziennie mniej więcej o tej samej porze, w razie potrzeby popijając niewielką ilością wody. Postępować zgodnie z kierunkiem strzałek aż do zużycia wszystkich 21 tabletek. Nie należy przyjmować tabletek w ciągu następnych 7 dni, podczas których powinny pojawić się miesiączki ( krwawienie z odstawienia), które zwykle rozpoczyna się 2-3 dni po przyjęciu ostatniej tabletki leku Miranova.Nowe opakowanie należy rozpocząć ósmego dnia, nawet jeśli miesiączka jeszcze się nie skończyła. Dzięki temu nowy pakiet będzie zawsze rozpoczynał się tego samego dnia tygodnia, a krwawienie z odstawienia zawsze będzie występować mniej więcej w te same dni tygodnia, co miesiąc. COCs, jeśli są przyjmowane prawidłowo, mają 1% wskaźnik niepowodzeń rocznie. Wskaźnik niepowodzenia wzrasta, gdy pigułki są zapomniane lub niewłaściwie przyjmowane.
Początek pierwszej paczki
- Brak antykoncepcji hormonalnej w poprzednim miesiącu Rozpocznij przyjmowanie leku Miranova w pierwszym dniu miesiączki, czyli w pierwszym dniu miesiączki, przyjmując tabletkę oznaczoną tym dniem tygodnia.Na przykład, jeśli miesiączka zaczyna się w piątek, zażyj pigułkę oznaczoną piątek. Następnie kontynuuj w kolejności wskazanej przez strzałki. Może również rozpocząć się między drugim a piątym dniem cyklu, ale w tym przypadku należy zastosować dodatkową metodę antykoncepcji (metoda barierowa) przez pierwsze siedem dni przyjmowania tabletek w pierwszym cyklu.
- Zmiana z krążka dopochwowego z krążka dopochwowego lub plastra z innej złożonej pigułki lub plastra Możesz rozpocząć przyjmowanie leku Miranova dzień po ostatniej pigułce poprzedniego środka antykoncepcyjnego (tj. bez zachowania przerwy). Jeśli poprzednie opakowanie antykoncepcyjne zawierało również tabletki bez substancji czynnej, lek Miranova można zażyć dzień po przyjęciu ostatniej tabletki zawierającej substancję czynną (w razie wątpliwości należy zapytać lekarza).Można również rozpocząć stosowanie później, ale nigdy później niż dzień po przerwie w przyjmowaniu tabletek. (lub dzień po ostatniej nieaktywnej tabletce) poprzedniego środka antykoncepcyjnego.Jeśli zastosowano krążek dopochwowy lub plaster, należy rozpocząć stosowanie leku Miranova najlepiej w dniu usunięcia ostatniego krążka lub plastra z cyklu lub najpóźniej. kiedy należy wykonać następną aplikację.
- Zmiana z pigułki zawierającej wyłącznie progestagen (minipigułka) Minipigułkę można przerwać dowolnego dnia i rozpocząć przyjmowanie leku Miranova następnego dnia o tej samej porze. Jednak w ciągu pierwszych siedmiu dni przyjmowania tabletek stosujesz dodatkową metodę antykoncepcji (metodę barierową) podczas stosunku.
- Zmiana z wstrzyknięcia lub implantacji środka antykoncepcyjnego lub systemu domacicznego uwalniającego progestagen (IUS) Stosowanie leku Miranova rozpoczyna się w dniu, w którym konieczne jest wykonanie kolejnego wstrzyknięcia lub w dniu usunięcia implantu, jednak w ciągu pierwszych siedmiu dni przyjmowania tabletek. stosuj dodatkową metodę antykoncepcji (metodę barierową) podczas uprawiania seksu.
- Po porodzie Rozpoczęcie przyjmowania pigułki po porodzie musi zostać ustalone przez lekarza. Decyduje, czy rozpocząć leczenie w okresie między 21 a 28 dniem, czy później. W tym drugim przypadku wskazane jest zastosowanie dodatkowej metody barierowej w ciągu pierwszych 7 dni przyjmowania tabletek, jednak jeśli w międzyczasie odbyłaś stosunek płciowy, przed rozpoczęciem przyjmowania tabletek należy wykluczyć ciążę lub poczekać na pierwsza się pojawiła menstruacja. Jeśli pacjentka karmi piersią i chce przyjmować lek Miranova, powinna najpierw porozmawiać z lekarzem (patrz „Ciąża i karmienie piersią”).
- Po poronieniu lub wywołanej aborcji Postępuj zgodnie z zaleceniami lekarza.
Pominięcie przyjęcia leku Miranova
- Jeśli od zwykłego spożycia minęło mniej niż 12 godzin, wiarygodność pigułki zostaje zachowana. Pominiętą tabletkę należy przyjąć natychmiast po przypomnieniu sobie i kontynuować leczenie jak zwykle.
- Jeśli od zwykłego zażycia minęło więcej niż 12 godzin, wiarygodność pigułki może być zmniejszona. Im większa liczba pominiętych kolejnych tabletek, tym większe ryzyko osłabienia działania antykoncepcyjnego.Ryzyko zajścia w ciążę jest szczególnie wysokie, jeśli zapomni się o tabletkach na początku i na końcu opakowania. Postępuj zgodnie z poniższymi instrukcjami (patrz również poniższy diagram).
Pominięto więcej niż jedną tabletkę w opakowaniu Należy skonsultować się z lekarzem.
Zapomniana jedna tabletka w pierwszym tygodniu
Zażyj tabletkę, gdy tylko sobie o tym przypomnisz (nawet jeśli oznacza to przyjęcie dwóch tabletek jednocześnie) i kontynuuj jak zwykle. Stosować dodatkowe metody antykoncepcji (metoda barierowa) przez kolejne 7 dni.
Jeśli odbyłaś stosunek seksualny w tygodniu poprzedzającym zapomnienie, istnieje możliwość, że zaszłaś w ciążę. Należy natychmiast powiadomić lekarza.
Zapomniano o jednej tabletce w drugim tygodniu
Pominiętą tabletkę należy przyjąć, gdy tylko sobie o tym przypomnisz (nawet jeśli oznacza to przyjęcie dwóch tabletek jednocześnie) i kontynuować jak zwykle. Niezawodność pigułki jest zachowana i nie są wymagane żadne dodatkowe środki antykoncepcyjne.
Pominięcie jednej tabletki w 3. tygodniu Możesz wybrać jedną z poniższych alternatyw, bez konieczności stosowania dodatkowych środków antykoncepcyjnych.
- Pominiętą tabletkę należy przyjąć, gdy tylko sobie o tym przypomnisz (nawet jeśli oznacza to przyjęcie dwóch tabletek jednocześnie) i kontynuować jak zwykle. Rozpocznij nowy pakiet, gdy tylko skończysz obecną, bez przerwy między dwoma pakietami. Krwawienie z odstawienia może wystąpić dopiero po zakończeniu drugiego opakowania, ale krwawienie międzymiesiączkowe (plamienie) może wystąpić w dniach przyjmowania leku.
- Należy przerwać przyjmowanie tabletek z dotychczasowego opakowania, zachować odstęp 7 dni lub mniej (licz także dzień pominiętej tabletki) i kontynuować przyjmowanie nowego opakowania.Jeśli wybierzesz tę alternatywę, zawsze możesz rozpocząć nowe opakowanie od tego samego dzień paczki tydzień, w którym zwykle się zaczyna.
Jeśli zapomnisz przyjąć jedną lub więcej tabletek i nie będziesz mieć miesiączki w pierwszej przerwie bez tabletek, możliwe jest, że jesteś w ciąży. Skonsultuj się z lekarzem przed rozpoczęciem nowego opakowania.
W przypadku zaburzeń żołądkowo-jelitowych (np. wymioty i/lub biegunka)
Jeśli w ciągu 3-4 godzin od zażycia leku Miranova wystąpią wymioty lub ciężka biegunka, możliwe jest, że substancja czynna nie została całkowicie wchłonięta, tak jakby pominięto tabletkę, dlatego należy postępować zgodnie z instrukcjami podanymi w przypadku pominięcia tabletek. .
Opóźniona miesiączka: co musisz wiedzieć
Chociaż nie jest to zalecane, możliwe jest opóźnienie miesiączki poprzez kontynuację nowego opakowania Miranova bez zachowania 7-dniowej przerwy.Podczas stosowania drugiego opakowania mogą wystąpić przełomowe krwawienia lub plamienia. Kontynuuj kolejne opakowanie po zwykłej 7-dniowej przerwie.
Poproś swojego lekarza o poradę przed podjęciem decyzji o opóźnieniu miesiączki.
Zmiana dnia rozpoczęcia miesiączki: co należy wiedzieć Jeśli przyjmujesz tabletki zgodnie z zaleceniami, miesiączka zacznie się mniej więcej tego samego dnia tygodnia.Jeśli musisz zmienić ten dzień, możesz skrócić (nigdy nie wydłużyć) normalna przerwa między dwoma paczkami Na przykład, jeśli twój okres zwykle zaczyna się w piątek i chcesz, aby zaczął się we wtorek (3 dni wcześniej), powinieneś zacząć następną paczkę 3 dni wcześniej.Jeśli zrobisz przerwę między dwoma cyklami zbyt krótko (na przykład 3 dni lub mniej), w tym okresie może nie wystąpić miesiączka, w którym to przypadku podczas kolejnego cyklu leczenia może wystąpić krwawienie lub plamienie.
Zapytaj swojego lekarza, jeśli nie masz pewności, jak postępować.
W przypadku nieoczekiwanego krwawienia
W przypadku wszystkich doustnych środków antykoncepcyjnych krwawienie z pochwy może wystąpić w pierwszych miesiącach stosowania między miesiączkami.Zazwyczaj nieregularne krwawienie ustępuje po przyzwyczajeniu się organizmu do pigułki (zwykle po około 3 cyklach przyjmowania).
Skonsultuj się z lekarzem, jeśli takie krwawienie utrzymuje się, staje się intensywne lub nawraca w odstępach czasu.
W przypadku braku miesiączki
Jeśli wszystkie tabletki zostały przyjęte prawidłowo, nie wystąpiły wymioty ani nie zostały zażyte inne leki, zajście w ciążę jest bardzo mało prawdopodobne. Kontynuuj stosowanie leku jak zwykle.
Jeśli twój okres nie występuje dwa razy z rzędu, możliwe, że jesteś w ciąży.
Natychmiast skonsultuj się z lekarzem. Nie rozpoczynaj nowego opakowania, dopóki lekarz nie wykluczy, że jesteś w ciąży.
Przerwanie stosowania leku Miranova
Możesz przerwać stosowanie Miranova w dowolnym momencie.Jeśli nie chcesz zajść w ciążę, skonsultuj się z lekarzem w sprawie innych metod kontroli ciąży.
Jeśli chcesz przerwać stosowanie leku Miranova z powodu chęci macierzyństwa, porozmawiaj ze swoim lekarzem.W takim przypadku zaleca się, aby przed próbą zajścia w ciążę poczekać, aż miesiączka znów będzie regularna.
W przypadku dalszych pytań dotyczących stosowania tego leku należy zwrócić się do lekarza lub farmaceuty.
Przedawkowanie Co zrobić w przypadku przyjęcia zbyt dużej dawki leku Miranova
Nie ma doniesień o poważnych działaniach niepożądanych podczas jednoczesnego przyjmowania kilku tabletek. W takim przypadku u młodych dziewcząt mogą wystąpić nudności, wymioty i łagodne krwawienia z pochwy. W przypadku przypadkowego połknięcia/przyjmowania przedawkowania leku Miranova należy natychmiast powiadomić lekarza lub udać się do najbliższego szpitala.
Skutki uboczne Jakie są skutki uboczne Miranova
Jak każdy lek, lek ten może powodować działania niepożądane, chociaż nie u każdego one wystąpią. Jeśli wystąpią jakiekolwiek działania niepożądane, zwłaszcza jeśli są ciężkie lub uporczywe, lub jeśli wystąpią jakiekolwiek zmiany w stanie zdrowia, które Twoim zdaniem mogą być spowodowane stosowaniem leku Miranova, należy poinformować o tym lekarza. U wszystkich kobiet stosujących złożone hormonalne środki antykoncepcyjne występuje zwiększone ryzyko powstania zakrzepów krwi w żyłach (żylna choroba zakrzepowo-zatorowa) lub zakrzepów krwi w tętnicach (tętnicza choroba zakrzepowo-zatorowa). Bardziej szczegółowe informacje na temat różnych zagrożeń związanych ze „stosowaniem złożonych hormonalnych środków antykoncepcyjnych” można znaleźć w części „Ostrzeżenia i środki ostrożności”.
Poważne skutki uboczne
Poważne działania niepożądane związane ze stosowaniem pigułki i związane z nią objawy opisano w rozdziałach „Kiedy zachować szczególną ostrożność stosując lek Miranova”, „Zakrzepy” i „Rak”. Więcej informacji można znaleźć w tych punktach i skonsultować się z lekarzem. natychmiast.
Następujące działania niepożądane były związane ze stosowaniem preparatu Miranova:
Często (może dotyczyć do 1 na 10 osób)
- mdłości,
- ból brzucha,
- przybranie na wadze,
- bół głowy,
- depresyjny nastrój,
- zmiana nastroju,
- wrażliwość piersi,
- ból biustu.
Niezbyt często (może dotyczyć do 1 na 100 osób)
- on wymiotował,
- biegunka,
- zatrzymanie płynów,
- migrena (jednostronny ból głowy),
- zmniejszone pożądanie seksualne,
- powiększenie piersi,
- reakcje skórne (wysypka, pokrzywka).
Rzadko (może dotyczyć do 1 na 1000 osób)
- nietolerancja soczewek kontaktowych,
- reakcje nadwrażliwości (alergia),
- redukcja wagi,
- zwiększone pożądanie seksualne,
- wydzielina z piersi,
- upławy,
- choroby skóry (rumień guzowaty, rumień wielopostaciowy).
- szkodliwe zakrzepy krwi w żyle lub tętnicy, na przykład: w nodze, stopie (ZŻG), płuca (ZP), zawał serca, udar, mini udar, przejściowe objawy podobne do objawów „ udaru, znanego jako przemijający napad niedokrwienny ( TIA), zakrzepy krwi w wątrobie, żołądku/jelitach, nerkach lub oku.
Prawdopodobieństwo powstania zakrzepów krwi może być większe, jeśli u pacjenta występują jakiekolwiek inne stany zwiększające to ryzyko (więcej informacji na temat stanów zwiększających ryzyko zakrzepów krwi i objawów zakrzepu krwi, patrz punkt „Ostrzeżenia i środki ostrożności”).
Inne skutki uboczne:
- oligomenorrhea (wydłużenie odstępu czasu między jedną miesiączką a następną),
- brak miesiączki (brak miesiączki),
- krwawienie międzymiesiączkowe.
U kobiet z dziedzicznym obrzękiem naczynioruchowym (rzadka dziedziczna choroba charakteryzująca się obrzękiem skóry, błon śluzowych i narządów wewnętrznych) estrogeny egzogenne (hormonalna terapia zastępcza) mogą wywoływać lub nasilać objawy obrzęku naczynioruchowego.
Przestrzeganie instrukcji zawartych w tej ulotce zmniejsza ryzyko wystąpienia działań niepożądanych.
Zgłaszanie skutków ubocznych
Jeśli wystąpią jakiekolwiek objawy niepożądane, w tym wszelkie możliwe działania niepożądane niewymienione w tej ulotce, należy porozmawiać z lekarzem lub farmaceutą. Działania niepożądane można również zgłaszać bezpośrednio za pośrednictwem krajowego systemu zgłaszania pod adresem www.agenziafarmaco.it/it/responsabili Zgłaszanie działań niepożądanych może pomóc w uzyskaniu dodatkowych informacji na temat bezpieczeństwa stosowania tego leku.
Wygaśnięcie i przechowywanie
Lek należy przechowywać w miejscu niewidocznym i niedostępnym dla dzieci.
Nie stosować tego leku po upływie terminu ważności zamieszczonego na pudełku (blister, pudełko) po „EXP”. Termin ważności oznacza ostatni dzień danego miesiąca, termin ważności oznacza produkt w nienaruszonym opakowaniu, prawidłowo przechowywany.
Nie stosować leku, jeśli zauważy się zmianę koloru lub kruszenie tabletki lub jeśli widoczne są jakiekolwiek inne widoczne oznaki zepsucia.
Przechowywać w temperaturze nieprzekraczającej 30 ° C. Przechowywać w oryginalnym opakowaniu w celu ochrony przed wilgocią.
Nie należy wyrzucać żadnych leków do kanalizacji ani domowych pojemników na odpadki. Należy zapytać farmaceutę, jak usunąć leki, których się już nie używa.Pomoże to chronić środowisko.
Inne informacje
Co zawiera Miranova
Substancjami czynnymi są: lewonorgestrel i etynyloestradiol. Każda tabletka powlekana zawiera 0,1 mg lewonorgestrelu i 0,02 mg etynyloestradiolu.
Pozostałe składniki to: laktoza jednowodna, skrobia kukurydziana, skrobia żelowana, powidon 25, stearynian magnezu, sacharoza, powidon 90, makrogol 6000, węglan wapnia, talk, glicerol 85%, dwutlenek tytanu, czerwony tlenek żelaza (E 172), tlenek żółty żelaza (E172), ester glikolu etylenowego kwasu montanowego (wosk E).
Opis wyglądu leku Miranova i co zawiera opakowanie
Tabletki powlekane do stosowania doustnego
Produkt pakowany jest w blister kalendarzowy zawierający 21 tabletek.
Ulotka pakietu źródłowego: AIFA (Włoska Agencja Leków). Treść opublikowana w styczniu 2016 r. Przedstawione informacje mogą być nieaktualne.
Aby mieć dostęp do najbardziej aktualnej wersji, warto wejść na stronę AIFA (Włoskiej Agencji Leków). Zastrzeżenie i przydatne informacje.
01.0 NAZWA PRODUKTU LECZNICZEGO
MIRANOVA 0,1 MG + 0,02 MG TABLETKI POWLEKANE
02.0 SKŁAD JAKOŚCIOWY I ILOŚCIOWY
Każda tabletka zawiera:
Aktywne zasady:
0,1 mg lewonorgestrelu, 0,02 mg etynyloestradiolu.
Substancje pomocnicze o znanym działaniu: laktoza, sacharoza
Pełny wykaz substancji pomocniczych, patrz punkt 6.1.
03.0 POSTAĆ FARMACEUTYCZNA
Tabletki powlekane.
04.0 INFORMACJE KLINICZNE
04.1 Wskazania terapeutyczne
Zapobieganie poczęciu.
Decyzja o przepisaniu preparatu Miranova musi uwzględniać indywidualne czynniki ryzyka występujące u kobiety, szczególnie te związane z żylną chorobą zakrzepowo-zatorową (ŻChZZ) oraz porównanie ryzyka ŻChZZ związanego ze stosowaniem preparatu Miranova i innych złożonych hormonalnych środków antykoncepcyjnych (patrz: pkt 4.3 i 4.4).
04.2 Dawkowanie i sposób podawania
Sposób podawania
Stosowanie doustne
Sposób rekrutacji
COCs, jeśli są przyjmowane prawidłowo, mają 1% wskaźnik niepowodzeń rocznie. Wskaźnik niepowodzenia wzrasta, gdy pigułki są zapomniane lub niewłaściwie przyjmowane.
Tabletki należy przyjmować w kolejności wskazanej na opakowaniu, codziennie o tej samej porze, w razie potrzeby z niewielką ilością płynu; dawka to jedna tabletka dziennie przez 21 kolejnych dni. Każde kolejne opakowanie należy rozpocząć po 7-dniowej przerwie w przyjmowaniu tabletek, podczas której zwykle występuje krwawienie z odstawienia. Zwykle rozpoczyna się to 2-3 dni po ostatniej tabletce i może nie zakończyć się przed rozpoczęciem następnego opakowania.
Sposoby rozpoczęcia leczenia
Brak antykoncepcji hormonalnej w poprzednim miesiącu
Przyjmowanie tabletek należy rozpocząć w pierwszym dniu naturalnego cyklu miesiączkowego (tj. w pierwszym dniu miesiączki).Możliwe jest również rozpoczęcie przyjmowania tabletek między drugim a piątym dniem cyklu, ale w tym przypadku podczas pierwszego cyklu zaleca się również stosowanie metody barierowej w pierwszych siedmiu dniach przyjmowania tabletek.
Zmiana z innego hormonalnego środka antykoncepcyjnego (złożony doustny środek antykoncepcyjny, pierścień dopochwowy lub plaster)
Pierwszą tabletkę najlepiej przyjąć następnego dnia po ostatniej tabletce zawierającej substancję czynną poprzedniego środka antykoncepcyjnego lub najpóźniej dzień po zwykłej przerwie bez tabletek lub dzień po ostatniej tabletce placebo poprzedniego środka antykoncepcyjnego. W przypadku zmiany z krążka dopochwowego lub plastra, kobieta powinna rozpocząć przyjmowanie preparatu Miranova najlepiej w dniu usunięcia ostatniego krążka lub plastra z cyklu naklejania lub najpóźniej w dniu, w którym miałaby zostać zaplanowana kolejna aplikacja.
Zmiana ze środka antykoncepcyjnego zawierającego wyłącznie progestagen (minipigułka, wstrzyknięcie, implant) lub z systemu domacicznego uwalniającego progestagen (IUS).
Kobieta może się zmienić w dowolnym momencie, jeśli przychodzi z minipigułki, a zażywanie Miranova musi rozpocząć następnego dnia. W przypadku wstrzyknięcia należy podać w dniu następnego wstrzyknięcia.We wszystkich tych przypadkach należy również zalecić kobiecie stosowanie wspomagającej niehormonalnej metody antykoncepcji przez pierwsze siedem dni przyjmowania tabletek.
Po aborcji w pierwszym trymestrze
Możliwe jest natychmiastowe rozpoczęcie bez konieczności stosowania dodatkowych środków antykoncepcyjnych.
Po porodzie lub aborcji w drugim trymestrze
Ponieważ bezpośredni okres poporodowy wiąże się ze zwiększonym ryzykiem powikłań zakrzepowo-zatorowych, stosowanie złożonych doustnych środków antykoncepcyjnych nie powinno rozpoczynać się przed 21-28 dniem po porodzie lub po poronieniu w drugim trymestrze ciąży. przyjmowania tabletek. Jeśli jednak w międzyczasie doszło do stosunku płciowego, należy wykluczyć ciążę lub poczekać na pierwszą miesiączkę przed rozpoczęciem COC.
W przypadku kobiet karmiących piersią patrz punkt 4.6.
Nieregularne spożycie
Bezpieczeństwo antykoncepcji może ulec zmniejszeniu w przypadku pominięcia tabletek, szczególnie jeśli pominięcie nastąpi w pierwszych dniach cyklu leczenia.
Jeśli opóźnienie w przyjęciu tabletki wynosi mniej niż 12 godzin, ochrona antykoncepcyjna nie jest zmniejszona.Pominiętą tabletkę należy przyjąć, gdy tylko sobie o tym przypomni, a kolejne tabletki należy przyjmować w zwykłym tempie.
Jeśli spóźnisz się o więcej niż 12 godzin z przyjęciem jakiejkolwiek tabletki, ochrona antykoncepcyjna nie jest już zapewniona.
Jeśli zapomnisz tabletu, obowiązują następujące zasady:
1. Nie wolno przerywać przyjmowania tabletek na dłużej niż 7 dni.
2. Osiągnięcie „odpowiedniego zahamowania osi podwzgórze-przysadka-jajnik” trwa 7 dni nieprzerwanego przyjmowania tabletek.
W związku z tym w codziennej praktyce można podać następujące wskazówki.
• Pierwszy tydzień
Ostatnią pominiętą tabletkę należy przyjąć, gdy tylko kobieta sobie o tym przypomni, nawet jeśli oznacza to przyjmowanie dwóch tabletek jednocześnie. Pozostałe tabletki należy przyjmować w zwykłym tempie. Ponadto przez kolejne 7 dni należy stosować metodę mechaniczną, taką jak prezerwatywa. Jeśli stosunek odbył się w poprzednim tygodniu, należy rozważyć możliwość zajścia w ciążę. Im większa liczba pominiętych tabletek i im krótszy okres bez tabletek, tym większe ryzyko zajścia w ciążę.
• Drugi tydzień
Ostatnią pominiętą tabletkę należy przyjąć, gdy tylko kobieta sobie o tym przypomni, nawet jeśli oznacza to przyjmowanie dwóch tabletek jednocześnie. Pozostałe tabletki należy przyjmować w zwykłym tempie. Nie ma konieczności stosowania dodatkowych metod antykoncepcji, pod warunkiem, że w ciągu 7 dni poprzedzających pierwszą pominiętą tabletkę tabletki były przyjmowane prawidłowo; jeśli jednak tak nie jest lub jeśli pominięto więcej niż jedną tabletkę, należy zalecić zastosowanie dodatkowych środków ostrożności przez 7 dni.
• Trzeci tydzień
Biorąc pod uwagę zbliżający się okres bez tabletek, ryzyko zmniejszonej skuteczności antykoncepcji jest większe. Jednak modyfikacja schematu przyjmowania tabletek może nadal zapobiegać zmniejszeniu ochrony antykoncepcyjnej. Przyjmując jedną z dwóch poniższych opcji, nie ma zatem potrzeby stosowania dodatkowych metod antykoncepcji, o ile w ciągu 7 dni poprzedzających pierwszą pominiętą tabletkę wszystkie tabletki były przyjmowane prawidłowo. W przeciwnym razie zaleca się przestrzeganie pierwszej z dwóch opcji, a także stosowanie dodatkowych środków ostrożności przez następne 7 dni.
1. Ostatnią pominiętą tabletkę należy przyjąć, gdy tylko kobieta sobie o tym przypomni, nawet jeśli oznacza to przyjmowanie dwóch tabletek jednocześnie. Pozostałe tabletki należy przyjmować w zwykłym tempie. Kolejne opakowanie należy rozpocząć natychmiast po zakończeniu poprzedniego, tj. bez zachowania odstępu bez tabletek między dwoma opakowaniami. W takim przypadku krwawienie z odstawienia jest mało prawdopodobne przed końcem drugiego opakowania; jednak podczas przyjmowania tabletek może wystąpić plamienie lub krwawienie śródcykliczne.
2. Można również zalecić zaprzestanie przyjmowania tabletek z dotychczasowego opakowania.Następnie należy zachować przerwę w przyjmowaniu tabletek do 7 dni, w tym również te, w których pominięto tabletki, a następnie kontynuować z nowym opakowaniem.
Jeśli pominięto tabletki i nie wystąpiło krwawienie z odstawienia w pierwszej regularnej przerwie w przyjmowaniu tabletek, należy wziąć pod uwagę możliwość zajścia w ciążę.
Zalecenia w przypadku zaburzeń żołądkowo-jelitowych
W przypadku ciężkich zaburzeń żołądkowo-jelitowych wchłanianie może być upośledzone i należy stosować dodatkowe środki antykoncepcyjne.
Jeśli w ciągu 3-4 godzin od przyjęcia tabletki wystąpią wymioty i (lub) biegunka, wchłanianie może nie być całkowite. W takim przypadku zalecenia przedstawione w sekcji „Nieregularne spożycie„. Jeśli nie chcesz zmieniać swojego zwykłego schematu dawkowania, powinieneś wziąć jedną lub więcej dodatkowych tabletek z nowego opakowania.
Jak przenieść okres z zawieszenia
Aby opóźnić miesiączkę, pacjentka musi kontynuować przyjmowanie tabletek, pobierając je bez przerwy z innego opakowania leku Miranova.Opóźnienie to może zostać przedłużone zgodnie z życzeniem pacjentki do końca drugiego opakowania tabletek. pacjent może mieć przełomowe krwawienia lub plamienia.Miranova należy regularnie wznawiać po zwykłej 7-dniowej przerwie.
W celu przesunięcia okresu na inny dzień tygodnia niż przewidywany zgodnie z harmonogramem pacjenta, przerwa bez leczenia może zostać skrócona do pożądanych dni.Im krótsza przerwa bez tabletek, tym większa możliwość niestosowania mieć przepływ, ale przełomowe krwawienie lub plamienie może wystąpić podczas przyjmowania następnego opakowania (np. gdy chcesz opóźnić miesiączkę).
Populacje specjalne
Populacja pediatryczna
Nie ustalono bezpieczeństwa i skuteczności stosowania preparatu Miranova u dzieci i młodzieży w wieku poniżej 18 lat Brak dostępnych danych.
Zaburzenia czynności wątroby
Miranova jest przeciwwskazany u kobiet z ciężką chorobą wątroby. Patrz rozdział 4.3.
Zaburzenia czynności nerek
Preparat Miranova nie był specjalnie badany u pacjentów z zaburzeniami czynności nerek.
04.3 Przeciwwskazania
Nadwrażliwość na substancje czynne lub na którąkolwiek substancję pomocniczą wymienioną w punkcie 6.1
Złożonych hormonalnych środków antykoncepcyjnych (COC) nie należy stosować w następujących stanach.
Jeśli którykolwiek z tych stanów pojawi się po raz pierwszy podczas stosowania COC, leczenie należy natychmiast przerwać.
- Obecność lub ryzyko żylnej choroby zakrzepowo-zatorowej (ŻChZZ)
• Żylna choroba zakrzepowo-zatorowa – obecna (przy przyjmowaniu leków przeciwzakrzepowych) lub przebyta ŻChZZ (np. zakrzepica żył głębokich [ZŻG] lub zatorowość płucna [ZP])
• Rozpoznana dziedziczna lub nabyta predyspozycja do żylnej choroby zakrzepowo-zatorowej, taka jak oporność na aktywowane białko C (w tym czynnik V Leiden), niedobór antytrombiny III, niedobór białka C, niedobór białka S
• Duży zabieg chirurgiczny z przedłużonym unieruchomieniem (patrz punkt 4.4)
• Wysokie ryzyko żylnej choroby zakrzepowo-zatorowej ze względu na obecność wielu czynników ryzyka (patrz punkt 4.4)
- Obecność lub ryzyko tętniczej choroby zakrzepowo-zatorowej (ATE)
• Tętnicza choroba zakrzepowo-zatorowa – obecna lub przebyta tętnicza choroba zakrzepowo-zatorowa (np. zawał mięśnia sercowego) lub stany zwiastujące (np. dławica piersiowa)
• Choroba naczyń mózgowych – obecny lub przebyty udar lub stany zwiastujące (np. przemijający napad niedokrwienny (TIA))
• Znana dziedziczna lub nabyta predyspozycja do tętniczej choroby zakrzepowo-zatorowej, taka jak hiperhomocysteinemia i przeciwciała antyfosfolipidowe (przeciwciała antykardiolipinowe, antykoagulant toczniowy)
• Historia migreny z ogniskowymi objawami neurologicznymi
• Wysokie ryzyko tętniczej choroby zakrzepowo-zatorowej z powodu obecności wielu czynników ryzyka (patrz punkt 4.4) lub obecności poważnego czynnika ryzyka, takiego jak:
• cukrzyca z objawami naczyniowymi
• ciężkie nadciśnienie
• ciężka dyslipoproteinemia
- patologia okulistyczna pochodzenia naczyniowego
- ciężka choroba wątroby, obecna lub przeszła, do czasu powrotu wartości czynności wątroby do normy;
- nowotwory wątroby, obecne lub przeszłe, łagodne lub złośliwe;
- Znane lub podejrzewane choroby nowotworowe zależne od steroidów płciowych (np. narządów płciowych lub piersi);
- niezdiagnozowane krwawienie z pochwy;
- potwierdzona lub podejrzewana ciąża;
- związek z Ritonavirem;
04.4 Specjalne ostrzeżenia i odpowiednie środki ostrożności dotyczące stosowania
Ostrzeżenia
W przypadku wystąpienia któregokolwiek z wymienionych poniżej warunków lub czynników ryzyka, należy omówić z kobietą przydatność preparatu Miranova.
W przypadku pogorszenia lub pierwszego pojawienia się któregokolwiek z tych czynników ryzyka lub stanów, kobieta powinna skontaktować się ze swoim lekarzem w celu ustalenia, czy należy przerwać stosowanie preparatu Miranova.
Ryzyko żylnej choroby zakrzepowo-zatorowej (ŻChZZ)
Stosowanie jakichkolwiek złożonych hormonalnych środków antykoncepcyjnych (COC) powoduje zwiększone ryzyko żylnej choroby zakrzepowo-zatorowej (ŻChZZ) w porównaniu z niestosowaniem. Produkty zawierające lewonorgestrel (w tym Miranova), norgestymat lub noretysteron wiążą się z niższym ryzykiem VTE. stosowanie preparatu Miranova powinno odbywać się wyłącznie po rozmowach z kobietą, aby upewnić się, że rozumie ona ryzyko VTE związane z preparatem Miranova, jak jej obecne czynniki ryzyka wpływają na to ryzyko oraz fakt, że ryzyko rozwoju VTE jest najwyższe w pierwszym roku Istnieją również dowody na to, że ryzyko zwiększa się, gdy zostanie wznowiony COC po przerwie trwającej 4 lub więcej tygodni.
Około 2 na 10 000 kobiet, które nie stosują CHC i nie są w ciąży, rozwinie ŻChZZ w okresie jednego roku. Jednak u jednej kobiety ryzyko może być znacznie wyższe, w zależności od jej podstawowych czynników ryzyka (patrz poniżej).
Szacuje się, że na 10 000 kobiet stosujących złożone hormonalne środki antykoncepcyjne zawierające lewonorgestrel około 6 rozwinie żylną chorobę zakrzepowo-zatorową w ciągu roku.
Najnowsze dowody sugerują, że ryzyko ŻChZZ po podaniu doustnych środków antykoncepcyjnych zawierających norgestymat jest podobne do ryzyka wywoływanego przez złożone doustne środki antykoncepcyjne zawierające lewonorgestrel.
Liczba ŻChZZ rocznie jest mniejsza niż przewidywana w ciąży lub w okresie poporodowym.
ŻChZZ może być śmiertelna w 1-2% przypadków.
Bardzo rzadko u osób stosujących złożone hormonalne środki antykoncepcyjne zgłaszano zakrzepicę innych naczyń krwionośnych, np. żył i tętnic wątrobowych, krezkowych, nerkowych, mózgowych lub siatkówkowych.
Czynniki ryzyka ŻChZZ
Ryzyko żylnych powikłań zakrzepowo-zatorowych u osób stosujących złożone hormonalne środki antykoncepcyjne może znacznie wzrosnąć, jeśli występują dodatkowe czynniki ryzyka, zwłaszcza jeśli występuje więcej niż jeden czynnik ryzyka (patrz tabela).
Miranova jest przeciwwskazana, jeśli u kobiety występuje kilka czynników ryzyka, które zwiększają jej ryzyko zakrzepicy żylnej (patrz punkt 4.3). Jeśli u kobiety występuje więcej niż jeden czynnik ryzyka, możliwe jest, że zwiększone ryzyko jest większe niż suma poszczególnych czynników; w takim przypadku należy wziąć pod uwagę całkowite ryzyko ŻChZZ. , nie należy przepisywać COC (patrz punkt 4.3).
Tabela: Czynniki ryzyka ŻChZZ
Nie ma zgody co do możliwej roli żylaków i zakrzepowego zapalenia żył powierzchownych w powstawaniu i progresji zakrzepicy żylnej.
Należy wziąć pod uwagę zwiększone ryzyko wystąpienia choroby zakrzepowo-zatorowej w ciąży, szczególnie w 6-tygodniowym okresie połogu (informacje dotyczące „Ciąża i laktacja”, patrz punkt 4.6).
Objawy ŻChZZ (zakrzepica żył głębokich i zatorowość płucna)
Jeśli wystąpią tego typu objawy, kobiety powinny natychmiast zwrócić się o pomoc lekarską i poinformować je, że przyjmują CHC.
Objawy zakrzepicy żył głębokich (DVT) mogą obejmować:
- jednostronny obrzęk nogi i/lub stopy lub wzdłuż żyły w nodze;
- ból lub tkliwość w nodze, która może być odczuwana tylko podczas stania lub chodzenia;
- zwiększone czucie ciepła w chorej nodze; czerwona lub przebarwiona skóra na nodze.
Objawy zatorowości płucnej (PE) mogą obejmować:
- nagły i niewyjaśniony początek duszności i szybkiego oddechu;
- nagły kaszel, który może być związany z krwiopluciem;
- ostry ból w klatce piersiowej;
- silne uczucie pustki w głowie lub zawroty głowy;
- szybkie lub nieregularne bicie serca.
Niektóre z tych objawów (takie jak „duszność” i „kaszel”) są niespecyficzne i mogą być błędnie interpretowane jako częstsze lub mniej poważne zdarzenia (np. infekcje dróg oddechowych).
Inne objawy niedrożności naczyń mogą obejmować: nagły ból, obrzęk lub bladoniebieskie przebarwienie jednej „kończyny”.
Jeśli okluzja ma miejsce w oku, objawy mogą obejmować bezbolesne niewyraźne widzenie lub utratę wzroku. Czasami utrata wzroku następuje niemal natychmiast.
Ryzyko tętniczej choroby zakrzepowo-zatorowej (ATE)
Badania epidemiologiczne wiążą stosowanie złożonych hormonalnych środków antykoncepcyjnych ze zwiększonym ryzykiem tętniczej choroby zakrzepowo-zatorowej (zawału mięśnia sercowego) lub incydentów naczyniowo-mózgowych (np. przemijający napad niedokrwienny, udar).Tętnicze zdarzenia zakrzepowo-zatorowe mogą być śmiertelne.
Czynniki ryzyka ATE
Ryzyko wystąpienia tętniczych powikłań zakrzepowo-zatorowych lub incydentów naczyniowo-mózgowych u osób stosujących złożone hormonalne środki antykoncepcyjne wzrasta w obecności czynników ryzyka (patrz tabela). Miranova jest przeciwwskazana, jeśli kobieta ma jeden poważny czynnik ryzyka lub wiele czynników ryzyka ATE, które zwiększają jej ryzyko zakrzepicy tętniczej (patrz punkt 4.3). Jeśli u kobiety występuje więcej niż jeden czynnik ryzyka, możliwe jest, że wzrost ryzyka jest większy niż suma poszczególnych czynników; w takim przypadku należy wziąć pod uwagę całkowite ryzyko. nie należy przepisywać CHC (patrz punkt 4.3).
Tabela: Czynniki ryzyka ATE
Objawy ATE
Jeśli wystąpią tego typu objawy, kobiety muszą: natychmiast skontaktuj się z pracownikiem służby zdrowia i poinformuj go, że przyjmuje CHC.
Objawy udaru naczyniowo-mózgowego mogą obejmować:
• nagłe drętwienie lub osłabienie twarzy, ręki lub nogi, zwłaszcza po jednej stronie ciała;
• nagłe trudności w chodzeniu, zawroty głowy, utrata równowagi lub koordynacji;
• nagłe splątanie, trudności w mówieniu lub rozumieniu;
• nagłe trudności z widzeniem w jednym lub obu oczach, podwójne widzenie;
• nagła, ciężka lub przedłużająca się migrena bez znanej przyczyny;
• utrata przytomności lub omdlenia z drgawkami lub bez drgawek.
• ostry brzuch
Tymczasowe objawy sugerują, że jest to przejściowy atak niedokrwienny (TIA).
Objawy zawału mięśnia sercowego (MI) mogą obejmować:
• ból, dyskomfort, ucisk, ciężkość, uczucie ściskania lub pełności w klatce piersiowej, ramieniu lub poniżej mostka;
• dyskomfort promieniujący do pleców, szczęki, gardła, ramion, żołądka;
• uczucie pełności, niestrawności lub zadławienia;
• pocenie się, nudności, wymioty lub zawroty głowy;
• skrajne osłabienie, niepokój lub duszność;
• szybkie lub nieregularne bicie serca.
Środki ostrożności dotyczące stosowania
Badania / wizyty lekarskie
Przed rozpoczęciem lub wznowieniem stosowania preparatu Miranova należy zebrać pełny wywiad chorobowy (w tym wywiad rodzinny) i wykluczyć ciążę. Należy zmierzyć ciśnienie krwi i przeprowadzić badanie fizykalne zgodnie z „Przeciwwskazaniami (patrz punkt 4.3) i Ostrzeżeniami (patrz punkt 4.4); badanie należy powtarzać podczas stosowania złożonych doustnych środków antykoncepcyjnych, co najmniej raz dziennie”. rok . Ważne jest, aby zwrócić uwagę kobiety na informacje dotyczące zakrzepicy żylnej lub tętniczej, w tym ryzyko związane ze stosowaniem preparatu Miranova w porównaniu z innymi złożonymi hormonalnymi środkami antykoncepcyjnymi, objawy ŻChZZ i ATE, znane czynniki ryzyka oraz postępowanie w przypadku podejrzenia zakrzepicy.
Należy również poinformować kobietę o konieczności uważnego przeczytania ulotki dołączonej do opakowania i zastosowania się do jej zaleceń. Częstotliwość i rodzaj badań powinna opierać się na ustalonych wytycznych i powinna być dostosowana do indywidualnej kobiety.
Należy poinformować kobiety, że hormonalne środki antykoncepcyjne nie chronią przed zakażeniem wirusem HIV (AIDS) ani innymi chorobami przenoszonymi drogą płciową.
Guzy
Rak narządów rodnych i piersi
W niektórych badaniach epidemiologicznych zgłaszano zwiększone ryzyko raka szyjki macicy u kobiet długotrwale leczonych złożonymi doustnymi środkami antykoncepcyjnymi; jednak nadal nie ma zgody co do zakresu, w jakim odkrycie to można przypisać mylącym skutkom spowodowanym zachowaniami seksualnymi i innymi czynnikami, takimi jak wirus brodawczaka ludzkiego (HPV).
Metaanaliza 54 badań epidemiologicznych wykazała, że kobiety stosujące złożone doustne środki antykoncepcyjne mają nieznacznie zwiększone ryzyko względne (RR = 1,24) rozpoznania raka piersi i że to nadmierne ryzyko stopniowo zanika w ciągu 10 lat od przerwania leczenia. Ponieważ rak piersi występuje rzadko u kobiet poniżej 40 roku życia, liczba dodatkowych przypadków raka piersi zdiagnozowanych u kobiet przyjmujących lub niedawno przyjmujących COC jest niska w porównaniu z bezwzględnym ryzykiem raka piersi. Badania te nie dostarczają dowodów na ten związek przyczynowy.
Obserwowane zwiększone ryzyko może wynikać z wcześniejszej diagnozy raka piersi u kobiet przyjmujących złożone doustne środki antykoncepcyjne, biologicznego wpływu złożonych doustnych środków antykoncepcyjnych lub połączenia obu tych czynników. Rak piersi zdiagnozowany u kobiet stosujących doustne środki antykoncepcyjne jest zwykle mniej zaawansowany klinicznie niż rak zdiagnozowany u kobiet, które nigdy nie stosowały doustnego środka antykoncepcyjnego.
Neoplazja wątroby
U kobiet przyjmujących złożone doustne środki antykoncepcyjne rzadko zgłaszano łagodne guzy wątroby, a jeszcze rzadziej złośliwe guzy wątroby. W pojedynczych przypadkach nowotwory te powodowały zagrażający życiu krwotok do jamy brzusznej. Jeśli u kobiety stosującej złożone doustne środki antykoncepcyjne wystąpi silny ból w nadbrzuszu, powiększenie wątroby lub objawy wskazujące na krwotok śródbrzuszny, w diagnostyce różnicowej należy wziąć pod uwagę możliwość raka wątroby.
Inne warunki
Funkcja wątroby
Ostre lub przewlekłe zaburzenia czynności wątroby mogą wymagać przerwania leczenia COC do czasu powrotu wskaźników czynności wątroby do normy.Powrót żółtaczki cholestatycznej i/lub świądu cholestatycznego występującego w ciąży lub podczas wcześniejszego leczenia steroidami płciowymi wymaga odstawienia złożonych doustnych środków antykoncepcyjnych.
Urazy oczu
Podczas stosowania złożonych doustnych środków antykoncepcyjnych zgłaszano przypadki zakrzepicy siatkówki.W przypadku niewyjaśnionej częściowej lub całkowitej utraty wzroku, wystąpienia wytrzeszczu lub podwójnego widzenia, obrzęku tarczy nerwu wzrokowego lub zmian naczyniowych siatkówki, należy przerwać stosowanie środków antykoncepcyjnych. przyczynę należy natychmiast ocenić.
Bół głowy
Pojawienie się lub zaostrzenie migreny lub rozwój bólu głowy o cechach nawracających, uporczywych i ciężkich to sytuacje, które wymagają odstawienia złożonego doustnego środka antykoncepcyjnego i oceny przyczyny.
Wpływ na metabolizm lipidów i węglowodanów
Chociaż złożone doustne środki antykoncepcyjne mogą wpływać na obwodową oporność na insulinę i tolerancję glukozy, nie ma dowodów na potrzebę dostosowania schematu leczenia u chorych na cukrzycę stosujących złożone doustne środki antykoncepcyjne.Jednak pacjentki z cukrzycą powinny być ściśle obserwowane, zwłaszcza w pierwszym okresie stosowania złożonych doustnych środków antykoncepcyjnych.
Kobiety z hipertriglicerydemią lub rodzinną historią tego stanu mogą mieć zwiększone ryzyko zapalenia trzustki podczas przyjmowania złożonych doustnych środków antykoncepcyjnych.
Poziom kwasu foliowego
Stężenie kwasu foliowego w surowicy można zmniejszyć przez skojarzoną doustną terapię antykoncepcyjną. Może to mieć znaczenie kliniczne, jeśli kobieta zajdzie w ciążę wkrótce po odstawieniu COC.
Zatrzymanie płynów
COC należy przepisywać ostrożnie kobietom, których stan zdrowia może ulec pogorszeniu w wyniku zatrzymania płynów.
Ciśnienie krwi
Stosowanie doustnych środków antykoncepcyjnych jest przeciwwskazane u kobiet z nadciśnieniem w wywiadzie, chorobami związanymi z nadciśnieniem lub chorobą nerek (patrz punkt 4.3). Chociaż u wielu kobiet stosujących złożone doustne środki antykoncepcyjne odnotowano niewielki wzrost ciśnienia krwi, klinicznie istotny wzrost występuje rzadko. Nie ustalono związku między stosowaniem COC a nadciśnieniem. Tylko w tych rzadkich przypadkach uzasadnione jest „natychmiastowe zaprzestanie” stosowania COC. Jeśli jednak podczas stosowania złożonych doustnych środków antykoncepcyjnych występuje stale podwyższone ciśnienie krwi z istniejącym wcześniej nadciśnieniem lub z klinicznie istotnym nadciśnieniem, nie ma odpowiedzi na leczenie przeciwnadciśnieniowe, należy odstawić złożone doustne środki antykoncepcyjne, jeśli uzna się to za właściwe. stosowanie należy wznowić, jeśli ciśnienie krwi powróci do normy po terapii przeciwnadciśnieniowej.
Patologie jelita
W związku ze stosowaniem COC zgłaszano pogorszenie choroby Leśniowskiego-Crohna i wrzodziejące zapalenie jelita grubego.
Zaburzenia sfery emocjonalnej
Kobiety, u których wystąpiła znaczna depresja podczas przyjmowania złożonych doustnych środków antykoncepcyjnych, powinny przerwać leczenie i zastosować alternatywną metodę antykoncepcji w celu ustalenia, czy ten objaw jest związany z przyjmowaniem leku.Kobiety z depresją w wywiadzie powinny być ściśle monitorowane i leczone. W przypadku wystąpienia ciężkiej depresji należy je odstawić.
Podczas przyjmowania złożonych doustnych środków antykoncepcyjnych może czasami wystąpić ostuda, zwłaszcza u kobiet, u których wystąpiła ostuda gravidarum; pacjenci ze skłonnością do ostudy powinni unikać ekspozycji na słońce lub promieniowanie ultrafioletowe podczas przyjmowania złożonych doustnych środków antykoncepcyjnych.
Wystąpienie lub pogorszenie wymienionych poniżej stanów zgłaszano zarówno w czasie ciąży, jak i podczas przyjmowania złożonych doustnych środków antykoncepcyjnych; jednak nie ma jednoznacznych dowodów dotyczących korelacji między tymi stanami a złożonymi doustnymi środkami antykoncepcyjnymi: żółtaczka i/lub świąd spowodowany cholestazą, tworzeniem kamieni żółciowych, porfirią, układem toczeń rumieniowaty, zespół mocznicowo-hemolityczny, pląsawica Sydenhama, opryszczka ciężarnych, utrata słuchu spowodowana otosklerozą.
U kobiet z dziedzicznym obrzękiem naczynioruchowym egzogenne estrogeny mogą wywoływać lub nasilać objawy obrzęku naczynioruchowego.
Zmniejszenie skuteczności
Skuteczność złożonych doustnych środków antykoncepcyjnych może ulec zmniejszeniu w przypadku pominięcia przyjęcia tabletek (patrz punkt 4.2), w przypadku wymiotów i (lub) biegunki (patrz punkt 4.2) lub w przypadku jednoczesnego stosowania innych produktów leczniczych (patrz punkt 4.5).
Preparatów Hypericum perforatum nie należy przyjmować jednocześnie z produktami leczniczymi zawierającymi doustne środki antykoncepcyjne, digoksynę, teofilinę, karbamazepinę, fenobarbital, fenytoinę ze względu na ryzyko obniżenia stężenia w osoczu i zmniejszonej skuteczności terapeutycznej doustnych środków antykoncepcyjnych, digoksynę, teofilinę, karbamazepinę, fenobarbital ( patrz punkt 4.5).
Zredukowana kontrola cyklu (nieregularne krwawienie)
W przypadku wszystkich doustnych estrogenów progestynowych, zwłaszcza w pierwszych miesiącach stosowania, mogą wystąpić nieregularne krwawienia (plamienie lub krwawienie śródcykliczne), dlatego ocena wszelkich nieregularnych krwawień staje się istotna po okresie dostosowawczym wynoszącym około trzech cykli leczenia.
Jeśli nieregularna utrata krwi utrzymuje się lub występuje po wcześniej normalnych cyklach, należy rozważyć przyczyny niehormonalne i podjąć odpowiednie środki diagnostyczne, aby wykluczyć nowotwór złośliwy lub ciążę. Takie środki diagnostyczne mogą obejmować łyżeczkowanie.
U niektórych kobiet krwawienie z odstawienia antykoncepcji może nie wystąpić w okresie przerwy w przyjmowaniu tabletek.Jeżeli doustny progestagen estrogenowy był przyjmowany zgodnie ze wskazówkami podanymi w punkcie 4.2, jest mało prawdopodobne, aby była w ciąży. Jeśli jednak COC nie został prawidłowo przyjęty przed pominięciem krwawienia z odstawienia lub jeśli nie wystąpiły dwa krwawienia z odstawienia, przed kontynuowaniem przyjmowania COC należy wykluczyć ciążę.
Ważne informacje o niektórych substancjach pomocniczych
Miranova zawiera laktozę. Pacjenci z rzadką dziedziczną nietolerancją galaktozy, niedoborem laktazy typu Lapp lub zespołem złego wchłaniania glukozy-galaktozy nie powinni przyjmować tego leku. Miranova zawiera sacharozę. Pacjenci z rzadką dziedziczną nietolerancją fruktozy, zespołem złego wchłaniania glukozy-galaktozy lub niedoborem izomaltazy sacharazy nie powinni przyjmować tego leku.
04.5 Interakcje z innymi produktami leczniczymi i inne formy interakcji
Wpływ innych produktów leczniczych na Miranova
Interakcje z innymi lekami indukującymi enzymy mikrosomalne, skutkujące zwiększonym klirensem hormonów płciowych, mogą prowadzić do przełomowego krwawienia i/lub niepowodzenia antykoncepcji.
Kobiety poddawane leczeniu jednym z tych leków muszą tymczasowo stosować metodę barierową lub inną metodę antykoncepcji oprócz złożonego doustnego środka antykoncepcyjnego. Metodę barierową należy stosować przez cały czas jednoczesnego przyjmowania leków oraz przez 28 dni po zakończeniu leczenia. Jeśli jednoczesne podawanie leku będzie kontynuowane po zakończeniu jednego opakowania COC, kolejne opakowanie COC należy rozpocząć bez zachowania zwyczajowej przerwy w przyjmowaniu tabletek.
Substancje zwiększające klirens COC (zmniejszona skuteczność COCs przez induktory enzymów)
Fenytoina, barbiturany, prymidon, karbamazepina, ryfabutyna, ryfampicyna, a także istnieją podejrzenia dotyczące oksykarbamazepiny, topiramatu, felbamatu, gryzeofulwiny i produktów zawierających „dziurawiec” (Hypericum perforatum).
Preparaty na bazie Hypericum perforatum nie powinny być stosowane jednocześnie z doustnymi środkami antykoncepcyjnymi, ponieważ może to prowadzić do utraty skuteczności antykoncepcyjnej.Zgłaszano niepożądane ciąże i wznawianie cyklu miesiączkowego.Jest to spowodowane indukcją enzymów odpowiedzialnych za metabolizm leki z preparatów na bazie Hypericum perforatum. Efekt indukcji może utrzymywać się przez co najmniej 2 tygodnie po zaprzestaniu leczenia produktami Hypericum perforatum.
Substancje o zmiennym wpływie na usuwanie COC
Rytonawir i Newirapina. Niektóre inhibitory proteazy HIV/HCV i nienukleozydowe inhibitory odwrotnej transkryptazy podawane z doustnymi środkami antykoncepcyjnymi mogą zwiększać lub zmniejszać stężenie estrogenu i progestagenu w osoczu. W niektórych przypadkach zmiany te mogą mieć znaczenie kliniczne.
Substancje zmniejszające klirens COC (inhibitory enzymów)
Silne lub umiarkowane inhibitory CYP3A4, takie jak azolowe leki przeciwgrzybicze (np. itrakonazol, worykonazol, flukonazol), werapamil, makrolidy (np. klarytromycyna, erytromycyna), diltiazem i sok grejpfrutowy mogą zwiększyć stężenie estrogenu, progestagenu lub obu tych substancji w osoczu.
Wykazano, że dawki etorykoksybu od 60 do 120 mg na dobę zwiększają stężenie etynyloestradiolu w osoczu odpowiednio o 37% i 60%, gdy jest przyjmowany jednocześnie ze złożonym hormonalnym środkiem antykoncepcyjnym zawierającym 0,035 mg etynyloestradiolu.
Stowarzyszenia niezalecane
• Modafinil: ryzyko zmniejszonej skuteczności antykoncepcji podczas leczenia i przez cykl po przerwaniu leczenia.
Stowarzyszenia do oceny
W przypadku długotrwałego leczenia induktorami enzymów wątrobowych zaleca się zwiększenie dawki steroidów antykoncepcyjnych. Jeżeli duża dawka doustnego środka antykoncepcyjnego nie jest wskazana lub wydaje się niezadowalająca lub niewiarygodna, np. w przypadku nieregularnych miesiączek, należy zalecić zastosowanie innej metody antykoncepcji.
Flunaryzyna: ryzyko mlekotoku z powodu zwiększonej wrażliwości tkanki piersi na prolaktynę w wyniku działania flunaryzyny.
Troleandomycyna może zwiększać ryzyko cholestazy wewnątrzwątrobowej, gdy jest podawana jednocześnie z złożonymi doustnymi środkami antykoncepcyjnymi.
Doustne środki antykoncepcyjne mogą wpływać na metabolizm niektórych składników aktywnych. Podczas jednoczesnego stosowania doustnych środków antykoncepcyjnych zgłaszano zwiększenie stężenia cyklosporyny w osoczu.Wykazano, że złożone doustne środki antykoncepcyjne indukują metabolizm lamotryginy poprzez doprowadzenie stężenia lamotryginy w osoczu do wartości poniżej wartości terapeutycznych.Przeprowadzono badania w celu oceny możliwego wpływu doustnych środków antykoncepcyjnych na aktywność CYP3A4 są sprzeczne, może to zależeć od rodzaju zastosowanej progestyny.
Wydaje się, że hamowanie aktywności CYP2C19 indukowane przez hormonalny środek antykoncepcyjny jest spowodowane przez etynyloestradiol.Podanie doustnego środka antykoncepcyjnego zawierającego etynyloestradiol powoduje nieznaczne zwiększenie stężenia substratów CYP3A4 (np. midazolamu) w osoczu.
Stężenia w osoczu substratów CYP1A2 (np. melatoniny i tyzanidyny) mogą znacznie wzrosnąć.
In vitro etynyloestradiol jest odwracalnym inhibitorem CYP2C19, CYP1A1 i CYP1A2 oraz nieodwracalnym inhibitorem CYP3A4/5, CYP2C8 i CYP2J2.
Inne formy interakcji
Testy laboratoryjne
Stosowanie steroidów antykoncepcyjnych może wpływać na wyniki niektórych badań laboratoryjnych, w tym parametrów biochemicznych czynności wątroby, tarczycy, nadnerczy i nerek, stężenia białek transportowych w osoczu, np. globuliny wiążącej kortykosteroidy i frakcji lipidów/lipoprotein, parametrów metabolizmu glukozy , koagulacja i fibrynoliza. Odchylenia są na ogół w zakresie normalnych wartości laboratoryjnych.
04.6 Ciąża i laktacja
Ciąża
Produkt nie jest wskazany w okresie ciąży.
W przypadku zajścia w ciążę podczas stosowania preparatu Miranova należy natychmiast przerwać stosowanie produktu.Szerokie badania epidemiologiczne nie wykazały zwiększonego ryzyka wad wrodzonych u dzieci urodzonych przez kobiety, które stosowały doustne środki antykoncepcyjne przed zajściem w ciążę. przyjmowanie doustnych środków antykoncepcyjnych na początku ciąży.
Po ponownym rozpoczęciu stosowania preparatu Miranova należy wziąć pod uwagę zwiększone ryzyko wystąpienia choroby zakrzepowo-zatorowej w okresie poporodowym (patrz punkty 4.2. i 4.4).
Dotychczas w zastosowaniu klinicznym, w przeciwieństwie do dietylostilbestrolu, wyniki licznych badań epidemiologicznych pozwalają na rozważenie zmniejszenia ryzyka wad rozwojowych estrogenami podawanymi we wczesnej ciąży, samodzielnie lub w skojarzeniu.
Ponadto zagrożeń związanych z różnicowaniem płci płodu (zwłaszcza żeńskiego), które opisano dla pierwszych wysoce androgenomimetycznych progestagenów, nie można ekstrapolować na nowsze progestageny (takie jak stosowane w tym produkcie leczniczym), które są wyraźnie mniej lub wcale androgenomimetyki.
W konsekwencji wykrycie ciąży u pacjentki przyjmującej „kombinację estrogenowo-progestagenową” nie uzasadnia przerwania ciąży.
Czas karmienia
COC mogą mieć wpływ na karmienie piersią, ponieważ mogą zmniejszać ilość i zmieniać skład mleka kobiecego.Dlatego należy odradzać stosowanie COC do końca karmienia piersią.Niewielkie ilości steroidów.środki antykoncepcyjne i/lub ich metabolity mogą być wydalane mleko matki. Te ilości mogą mieć wpływ na dziecko.
04.7 Wpływ na zdolność prowadzenia pojazdów i obsługiwania maszyn
Miranova nie ma wpływu lub ma nieistotny wpływ na zdolność prowadzenia pojazdów i obsługiwania maszyn.
04.8 Działania niepożądane
Podsumowanie profilu bezpieczeństwa
Najczęstsze działania niepożądane związane ze stosowaniem preparatu Miranova to nudności, ból brzucha, przyrost masy ciała, ból głowy, stany depresyjne, zmiany nastroju, ból piersi, tkliwość piersi.Występują u ≥ 1% użytkowników.
Poważne działania niepożądane to tętnicza i żylna choroba zakrzepowo-zatorowa.
Tabela działań niepożądanych
U osób stosujących COC zgłoszono następujące działania niepożądane.
Działania niepożądane są zgłaszane według klasyfikacji układów i narządów ze wskazanymi częstościami:
** - Szacowana częstość na podstawie badań epidemiologicznych obejmujących grupę złożonych doustnych środków antykoncepcyjnych.
- „Żylna choroba zakrzepowo-zatorowa (ŻChZZ), tętnicza choroba zakrzepowo-zatorowa (ATE)” podsumowuje następujące patologie: niedrożność żył głębokich obwodowych, zakrzepicę i zator naczyniowy/płuc, zakrzepicę, zator i zawał serca/zawał mięśnia sercowego/zawał mózgu i udar mózgu nieokreślony jako krwotoczny
Do opisania konkretnej reakcji użyto bardziej odpowiedniego terminu MedDRA. Synonimy i powiązane warunki nie znajdują się na liście, ale należy je wziąć pod uwagę.
Opis niektórych działań niepożądanych
U osób stosujących złożone hormonalne środki antykoncepcyjne obserwowano zwiększone ryzyko wystąpienia tętniczych i żylnych zdarzeń zakrzepowych i zakrzepowo-zatorowych, w tym zawału mięśnia sercowego, udaru mózgu, przemijających napadów niedokrwiennych, zakrzepicy żylnej i zatorowości płucnej. Ryzyko to omówiono bardziej szczegółowo w punkcie 4.4.
Następujące ciężkie działania niepożądane zgłaszano u osób stosujących złożone doustne środki antykoncepcyjne i omówiono je w punkcie 4.4 „Specjalne ostrzeżenia i środki ostrożności dotyczące stosowania”:
• żylne patologie zakrzepowo-zatorowe
• tętnicze patologie zakrzepowo-zatorowe
• nadciśnienie
• guzy wątroby
• Choroba Leśniowskiego-Crohna, wrzodziejące zapalenie jelita grubego, porfiria, toczeń rumieniowaty układowy, opryszczka ciężarnych, pląsawica Sydenhama, zespół mocznicowo-hemolityczny, żółtaczka cholestatyczna.
U kobiet z dziedzicznym obrzękiem naczynioruchowym egzogenne estrogeny mogą wywoływać lub nasilać objawy obrzęku naczynioruchowego.
Istnieje zwiększone ryzyko żylnej choroby zakrzepowo-zatorowej (ŻChZZ) u wszystkich kobiet stosujących złożone doustne środki antykoncepcyjne. Informacje na temat różnic w ryzyku pomiędzy złożonymi doustnymi środkami antykoncepcyjnymi, patrz punkt 4.4.
U kobiet stosujących złożone doustne środki antykoncepcyjne zgłaszano następujące działania niepożądane:
• Stosunkowo rzadkie działania niepożądane, które jednak wymagają przerwania leczenia:
• tętnicze incydenty zakrzepowo-zatorowe (w szczególności zawał mięśnia sercowego, udar naczyniowy mózgu);
• żylne incydenty zakrzepowo-zatorowe (zapalenie żył, zator tętnicy płucnej);
• nadciśnienie, choroba wieńcowa;
• hiperlipidemia (hipertriglicerydemia i/lub hipercholesterolemia);
• ciężka mastodynia, łagodna mastopatia;
• zaostrzenie padaczki;
• gruczolak wątroby, żółtaczka cholestatyczna;
• ostuda.
• Najczęstsze działania niepożądane, które na ogół nie wymagają przerwania leczenia, ale w przypadku których można rozważyć zastosowanie alternatywnej doustnej kombinacji antykoncepcyjnej:
• ciężkość nóg;
• krwawienie międzymiesiączkowe, skąpe miesiączki, brak miesiączki.
• Rzadko:
• zaburzenia skórne (trądzik, łojotok, nadmierne owłosienie)
• Inne skutki uboczne: kamica żółciowa.
• Wpływ na przerwanie leczenia: brak miesiączki po leczeniu.
Brak miesiączki bez owulacji (występujący częściej u kobiet z wcześniejszymi nieprawidłowościami cyklu) może być obserwowany po przerwaniu leczenia. Zwykle ustępuje samoistnie. Jeśli to się utrzyma, wskazane jest zbadanie możliwości wystąpienia zaburzeń przysadki przed jakąkolwiek kolejną receptą.
Bardzo nieznacznie wzrosła częstotliwość diagnozowania raka piersi wśród stosujących doustne środki antykoncepcyjne. Ponieważ rak piersi występuje rzadko u kobiet poniżej 40 roku życia, dodatkowa liczba przypadków jest niewielka w porównaniu z ogólnym ryzykiem raka piersi. Nie wiadomo, czy istnieje związek przyczynowy z COC. Więcej informacji można znaleźć w punktach 4.3 „Przeciwwskazania” i 4.4 „Specjalne ostrzeżenia i środki ostrożności dotyczące stosowania”.
Zgłaszanie podejrzewanych działań niepożądanych
Zgłaszanie podejrzewanych działań niepożądanych występujących po dopuszczeniu produktu leczniczego do obrotu jest ważne, ponieważ umożliwia ciągłe monitorowanie stosunku korzyści do ryzyka produktu leczniczego. Osoby należące do fachowego personelu medycznego powinny zgłaszać wszelkie podejrzewane działania niepożądane za pośrednictwem krajowego systemu zgłaszania. „adres www. agenziafarmaco.gov.it/it/responsabili
04.9 Przedawkowanie
Nie zgłoszono żadnych poważnych działań niepożądanych związanych z przedawkowaniem.
Objawy, które mogą być spowodowane przedawkowaniem, to nudności, wymioty, a u młodych dziewcząt łagodne krwawienie z pochwy.
Nie ma odtrutek, a dalsze leczenie powinno być objawowe.
05.0 WŁAŚCIWOŚCI FARMAKOLOGICZNE
05.1 Właściwości farmakodynamiczne
Grupa farmakoterapeutyczna: progestageny i estrogeny, preparaty złożone, kod ATC: G03AA07.
Działanie antykoncepcyjne preparatu Miranova opiera się na interakcji kilku czynników, z których najważniejszym jest zahamowanie owulacji i zmienności wydzielania śluzu szyjkowego, ponadto endometrium nie nadaje się do implantacji.
05.2 Właściwości farmakokinetyczne
Lewonorgestrel
Wchłanianie
Lewonorgestrel podawany doustnie jest szybko i całkowicie wchłaniany. Po jednorazowym podaniu maksymalne stężenie w surowicy, odpowiadające 2,3 ng/ml, jest osiągane po około 1,3 h. Lewonorgestrel jest całkowicie biodostępny po podaniu doustnym.
Dystrybucja
Lewonorgestrel wiąże się z albuminą surowicy i globuliną wiążącą hormony płciowe (SHBG). Tylko 1,1% całkowitego stężenia występuje w postaci wolnego steroidu, około 65% wiąże się specyficznie z SHBG, a około 34% jest niespecyficznie związane z albuminą. Wzrost SHBG wywołany etynyloestradiolem wpływa na stosunek związanego lewonorgestrelu do białek surowicy, powodując zwiększenie frakcji związanej z SHBG i zmniejszenie frakcji związanej z albuminą.Pozorna objętość dystrybucji lewonorgestrelu wynosi około 129 l po jednorazowym wlot.
Metabolizm
Lewonorgestrel jest całkowicie metabolizowany. Najważniejszymi metabolitami w osoczu są skoniugowane i nieskoniugowane formy 3a, 5b-tetrahydrolewonorgestrelu. W oparciu o badania in vitro i in vivo, CYP3A4 jest głównym enzymem biorącym udział w metabolizmie lewonorgestrelu.
Klirens metaboliczny wynosi około 1,0 ml/min/kg.
Eliminacja
Poziomy lewonorgestrelu w surowicy zmniejszają się w dwóch etapach. Faza końcowa charakteryzuje się okresem półtrwania wynoszącym około 25 h. Lewonorgestrel nie jest eliminowany w postaci zmodyfikowanej, jego metabolity są wydalane z kałem i moczem w stosunku około 1 do 1. Okres półtrwania wydalania metabolitów wynosi około około 1 dzień.
Warunki stanu ustalonego
Po codziennym przyjmowaniu leku, stężenie w surowicy wzrasta około trzykrotnie, osiągając stan stacjonarny w drugiej połowie cyklu leczenia.Na farmakokinetykę lewonorgestrelu wpływa stężenie SHBG, które zwiększa się 1,5-1,6-krotnie po przyjęciu etynyloestradiolu. stan, klirens i objętość dystrybucji są nieznacznie zmniejszone odpowiednio do 0,7 ml/min/kg i około 100 l.
Około 0,1% dawki przenika do mleka matki.
Etynyloestradiol
Wchłanianie
Etynyloestradiol podawany doustnie jest szybko i całkowicie wchłaniany, a po jednorazowym podaniu maksymalne stężenie w surowicy, odpowiadające 50 pg/ml, jest osiągane w ciągu 1-2 godzin po podaniu. Podczas wchłaniania i pierwszego pasażu w wątrobie etynyloestradiol jest dalej metabolizowany, co skutkuje średnią biodostępnością po podaniu doustnym około 45%, z dużymi różnicami indywidualnymi wynoszącymi około 20-65%.
Dystrybucja
Etynyloestradiol wiąże się głównie, ale nie specyficznie, z albuminą surowicy (około 98%) i indukuje wzrost stężenia SHBG w surowicy. Zgłaszano, że pozorna objętość dystrybucji wynosi około 2,8-8,6 l/kg.
Metabolizm
Etynyloestradiol podlega znacznemu metabolizmowi jelitowemu i wątrobowemu pierwszego przejścia.Etynyloestradiol i jego oksydacyjne metabolity są głównie sprzężone z glukuronidami i siarczanami. Klirens metaboliczny etynyloestradiolu wynosi około 2,3-7 ml/min/kg.
Eliminacja
Stężenie etynyloestradiolu w surowicy zmniejsza się w dwóch fazach charakteryzujących się okresami półtrwania wynoszącymi odpowiednio około 1 godziny i około 10-20 h. Etynyloestradiol nie jest eliminowany w postaci zmodyfikowanej, metabolity etynyloestradiolu są wydalane z kałem i moczem w stosunku około 4 do 6. Okres półtrwania wydalania metabolitów wynosi około 1 dnia.
Warunki stanu ustalonego
Stężenie etynyloestradiolu w surowicy zwiększa się około dwukrotnie po codziennym przyjmowaniu produktu Miranova.Zgodnie ze zmiennym okresem półtrwania w końcowej fazie dyspersji z surowicy i dobowego spożycia, stan stacjonarny stężenia etynyloestradiolu w surowicy osiągany jest po około tygodniu.
W okresie laktacji około 0,02% dawki może przenikać do mleka matki.
05.3 Przedkliniczne dane o bezpieczeństwie
Dane niekliniczne, oparte na konwencjonalnych badaniach toksyczności po podaniu wielokrotnym, dotyczących genotoksyczności, potencjalnego działania rakotwórczego i toksycznego wpływu na reprodukcję, nie zgłaszają szczególnych zagrożeń dla ludzi.
W zasadzie należy jednak pamiętać, że sterydy płciowe mogą stymulować wzrost tkanek i nowotworów zależnych od hormonów.
06.0 INFORMACJE FARMACEUTYCZNE
06.1 Zaróbki
Monohydrat laktozy, skrobia kukurydziana, wstępnie żelatynizowana skrobia, powidon 25; stearynian magnezu, sacharoza, powidon 90, makrogol 6000, węglan wapnia, talk, glicerol 85%, czerwony tlenek żelaza (E172), żółty tlenek żelaza (E172), dwutlenek tytanu, ester glikolu etylenowego kwasu montanowego (wosk E).
06.2 Niekompatybilność
Nieznany.
06.3 Okres ważności
3 lata.
06.4 Specjalne środki ostrożności przy przechowywaniu
Przechowywać w temperaturze nieprzekraczającej 30°C. Przechowywać w oryginalnym opakowaniu w celu ochrony leku przed wilgocią.
06.5 Rodzaj opakowania bezpośredniego i zawartość opakowania
Pojemnik główny: blister z polichlorku winylu/aluminium
Opakowanie: opakowanie kalendarza zawierające 21 tabletek
06.6 Instrukcje użytkowania i obsługi
Brak specjalnych instrukcji dotyczących utylizacji.
07.0 PODMIOT POZWOLENIA NA DOPUSZCZENIE DO OBROTU
Bayer SpA - Viale Certosa, 130 - 20156 Mediolan (MI)
08.0 NUMER POZWOLENIA NA DOPUSZCZENIE DO OBROTU
AIC n. 033779012
09.0 DATA PIERWSZEGO ZEZWOLENIA LUB PRZEDŁUŻENIA ZEZWOLENIA
10.04.2000 / 01 czerwca 2010
10.0 DATA ZMIAN TEKSTU
Ustalenie AIFA z dnia 09.2014










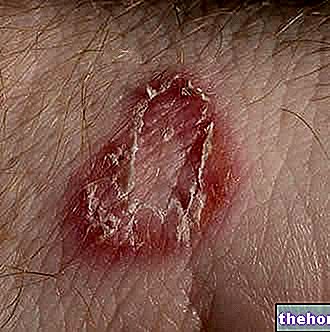











-panettone-di-pasqua.jpg)