Składniki aktywne: Flukonazol
Zoloder 100 mg kapsułki twarde
Zoloder 150 mg kapsułki twarde
Zoloder 200 mg kapsułki twarde
Wskazania Dlaczego stosuje się Zoloder? Po co to jest?
Zoloder należy do grupy leków zwanych „przeciwgrzybiczymi”. Substancją czynną jest flukonazol.
Zoloder jest stosowany w leczeniu zakażeń drożdżakami i może być stosowany w zapobieganiu zakażeniom drożdżakami. Najczęstszą przyczyną infekcji drożdżakowych są drożdżaki zwane Candida.
Dorośli ludzie
Lekarz może przepisać ten lek w leczeniu następujących zakażeń grzybiczych:
- kryptokokowe zapalenie opon mózgowych
- „grzybicze zakażenie mózgu;
- kokcydioidomikoza
- choroba układu oskrzelowo-płucnego;
- infekcje wywołane przez Candida i występujące w krwiobiegu, narządach (np. serce, płuca) lub drogach moczowych;
- kandydoza błon śluzowych
- infekcje błony śluzowej jamy ustnej, infekcje gardła i protetyczne zapalenie jamy ustnej;
- kandydoza narządów płciowych
- infekcja pochwy lub penisa;
- infekcje skóry
- np. grzybica, grzybica, swędzenie w okolicy narządów płciowych, infekcje paznokci.
Zoloder można przepisać na:
- zapobiegać nawrotom kryptokokowego zapalenia opon mózgowych;
- zapobiegać ponownemu pojawieniu się kandydozy błony śluzowej;
- zmniejszyć nawroty kandydozy pochwy;
- zapobiegać infekcjom Candida (jeśli Twój układ odpornościowy jest słaby lub nie działa prawidłowo).
Dzieci i młodzież (od 0 do 17 lat)
Lekarz może przepisać ten lek w leczeniu następujących zakażeń grzybiczych:
- kandydoza błon śluzowych
- infekcja błony śluzowej jamy ustnej, infekcja gardła;
- infekcje wywołane przez Candida i występujące w krwiobiegu, narządach (np. serce, płuca) lub drogach moczowych;
- kryptokokowe zapalenie opon mózgowych
- „zakażenie grzybicze mózgu.
Zoloder można przepisać na:
- zapobiegać infekcjom Candida (jeśli Twój układ odpornościowy jest słaby lub nie działa prawidłowo);
- zapobiegać nawrotom kryptokokowego zapalenia opon mózgowych.
Przeciwwskazania Kiedy nie należy stosować leku Zoloder
Nie należy przyjmować leku Zoloder, jeśli
- pacjent ma uczulenie na flukonazol, inne leki stosowane w leczeniu zakażeń grzybiczych lub którykolwiek z pozostałych składników tego leku (wymienionych w punkcie 6). Objawy mogą obejmować swędzenie, zaczerwienienie skóry lub trudności w oddychaniu.
- pacjent przyjmuje astemizol, terfenadynę (leki przeciwhistaminowe stosowane w leczeniu alergii);
- pacjent przyjmuje cyzapryd (stosowany w leczeniu zaburzeń żołądka);
- przyjmować pimozyd (stosowany w leczeniu zaburzeń psychicznych);
- przyjmować chinidynę (stosowaną w leczeniu zaburzeń rytmu serca);
- pacjent przyjmuje erytromycynę (antybiotyk stosowany w leczeniu zakażeń bakteryjnych).
Środki ostrożności dotyczące stosowania Informacje ważne przed zastosowaniem leku Zoloder
Przed rozpoczęciem przyjmowania leku Zoloder należy omówić to z lekarzem lub farmaceutą.
Należy powiedzieć lekarzowi, zwłaszcza jeśli:
- mieć problemy z wątrobą lub nerkami;
- cierpią na choroby serca, w tym arytmię serca;
- mieć nieprawidłowy poziom potasu, wapnia lub magnezu we krwi;
- pojawiają się ciężkie reakcje skórne (swędzenie, zaczerwienienie skóry lub trudności w oddychaniu).
Interakcje Jakie leki lub pokarmy mogą modyfikować działanie leku Zoloder
Należy natychmiast poinformować lekarza, jeśli pacjent przyjmuje astemizol, terfenadynę (lek przeciwhistaminowy stosowany w leczeniu alergii) lub cyzapryd (stosowany w leczeniu dolegliwości żołądkowych) lub pimozyd (stosowany w leczeniu zaburzeń psychicznych) lub chinidynę (stosowany w leczeniu zaburzeń rytmu serca) lub erytromycynę (stosowany antybiotyk w leczeniu zakażeń bakteryjnych), ponieważ nie można ich przyjmować z lekiem Zoloder (patrz punkt: „Nie stosować leku Zoloder, jeśli pacjentka”).
Istnieje kilka leków, które mogą wchodzić w interakcje z lekiem Zoloder. Należy poinformować lekarza, jeśli pacjent przyjmuje którykolwiek z następujących leków:
- ryfampicyna lub ryfabutyna (antybiotyki do leczenia infekcji bakteryjnych);
- alfentanyl, fentanyl (środki znieczulające);
- amitryptylina, nortryptylina (leki przeciwdepresyjne);
- amfoterycyna B, worikonazol (środki przeciwgrzybicze);
- leki rozrzedzające krew zapobiegające powstawaniu zakrzepów (warfaryna lub podobne leki);
- benzodiazepiny (midazolam, triazolam lub podobne leki) ułatwiające zasypianie lub uspokajające;
- karbamazepina, fenytoina (stosowane w leczeniu drgawek);
- nifedypina, izradypina, amlodypina, felodypina i losartan (stosowane w leczeniu nadciśnienia
- wysokie ciśnienie krwi);
- cyklosporyna, ewerolimus, sirolimus lub takrolimus (stosowane w zapobieganiu odrzuceniu przeszczepu);
- cyklofosfamid, alkaloidy barwinka (winkrystyna, winblastyna lub podobne leki) stosowane w leczeniu raka;
- halofantryna (stosowana w leczeniu malarii);
- statyny (atorwastatyna, simwastatyna, fluwastatyna i podobne leki) stosowane w celu obniżenia wysokiego poziomu cholesterolu;
- metadon (stosowany w leczeniu bólu);
- celekoksyb, flurbiprofen, naproksen, ibuprofen, lornoksykam, meloksykam, diklofenak (niesteroidowe leki przeciwzapalne - NLPZ);
- Doustne środki antykoncepcyjne;
- prednizon (steroid);
- zydowudyna, znana również jako AZT; sakwinawir (stosowany u pacjentów z HIV);
- leki na cukrzycę, takie jak chlorpromamid, glibenklamid, glipizyd lub tolbutamid;
- teofilina (stosowana do kontrolowania astmy);
- witamina A (suplement diety).
Należy powiedzieć lekarzowi lub farmaceucie, jeśli pacjent przyjmuje, ostatnio przyjmował lub może przyjmować jakiekolwiek inne leki.
Zoloder z jedzeniem i piciem
Lek można przyjmować z jedzeniem lub bez jedzenia.
Ostrzeżenia Ważne jest, aby wiedzieć, że:
Ciąża i karmienie piersią
Jeśli pacjentka jest w ciąży lub karmi piersią, podejrzewa, że może być w ciąży lub planuje mieć dziecko, powinna poradzić się lekarza lub farmaceuty przed zastosowaniem tego leku.
Nie należy przyjmować leku Zoloder, jeśli pacjentka jest w ciąży lub karmi piersią, chyba że tak zalecił lekarz.
Prowadzenie i używanie maszyn
Należy pamiętać, że podczas prowadzenia pojazdów lub obsługiwania maszyn mogą wystąpić zawroty głowy lub drgawki.
Zoloder zawiera laktozę
Ten lek zawiera niewielką ilość laktozy (cukru mlecznego). Jeśli lekarz poinformował Cię o „nietolerancji niektórych cukrów”, przed przyjęciem tego leku należy skontaktować się z lekarzem.
Dawka, sposób i czas podawania Jak stosować Zoloder: dawkowanie
Lek należy zawsze stosować zgodnie z zaleceniami lekarza. W razie wątpliwości skonsultuj się z lekarzem lub farmaceutą.
Kapsułkę należy połknąć w całości, popijając szklanką wody. Kapsułki najlepiej przyjmować codziennie o tej samej porze.
Zalecane dawki tego leku, które należy przyjmować w zależności od zakażenia, wymieniono poniżej:
Dorośli ludzie
Stosowanie u młodzieży w wieku od 12 do 17 lat
Zawsze należy przyjmować dawkę przepisaną przez lekarza (albo dawkę dla dorosłych, albo dawkę dla dzieci).
Stosować u dzieci do 11 lat
Maksymalna dawka u dzieci wynosi 400 mg na dobę.
Dawka będzie oparta na wadze dziecka w kilogramach
Stosować u dzieci w wieku od 0 do 4 tygodni
Stosowanie u dzieci w wieku od 3 do 4 tygodni:
Taka sama dawka jak opisano powyżej, ale podawana raz na 2 dni. Maksymalna dawka wynosi 12 mg na kg masy ciała co 48 godzin.
Stosowanie u niemowląt poniżej 2 tygodnia życia:
Taka sama dawka, jak opisano powyżej, ale podawana raz na 3 dni. Maksymalna dawka wynosi 12 mg na kg masy ciała co 72 godziny.
Lekarz może czasami przepisać dawki inne niż te. Lek należy zawsze przyjmować zgodnie z zaleceniami lekarza. W razie wątpliwości należy zwrócić się do lekarza lub farmaceuty.
Używaj u osób starszych
Należy stosować taką samą dawkę jak dla dorosłych, chyba że pacjent ma problemy z nerkami.
Stosowanie u pacjentów z problemami z nerkami
Lekarz może dostosować dawkę w zależności od czynności nerek.
Przedawkowanie Co zrobić, jeśli pacjent przyjął zbyt dużą dawkę leku Zoloder
Przyjęcie większej niż zalecana dawki leku Zoloder
Przyjmowanie zbyt wielu kapsułek na raz może spowodować problemy. Natychmiast skontaktuj się z lekarzem lub udaj się do najbliższego szpitala. W przypadku przypadkowego przedawkowania objawy mogą obejmować słyszenie, widzenie, odczuwanie i myślenie o rzeczach nierzeczywistych (omamy i zachowania paranoidalne). Wskazane może być leczenie objawowe (z odpowiednimi środkami podtrzymującymi i ewentualnie płukaniem żołądka).
Pominięcie przyjęcia leku Zoloder
Nie należy stosować dawki podwójnej w celu uzupełnienia pominiętych dawek. Jeśli zapomnisz przyjąć dawkę, zażyj ją tak szybko, jak to możliwe. Jeśli nadszedł czas na kolejną dawkę, pomiń pominiętą dawkę.
W przypadku dalszych pytań dotyczących stosowania tego leku należy zwrócić się do lekarza lub farmaceuty.
Skutki uboczne Jakie są skutki uboczne Zoloder
Jak każdy lek, lek ten może powodować działania niepożądane, chociaż nie u każdego one wystąpią.
Niektórzy ludzie doświadczają reakcji alergicznych, chociaż ciężkie reakcje alergiczne występują rzadko. Jeśli wystąpi którykolwiek z poniższych objawów, należy natychmiast poinformować o tym lekarza.
- nagły świszczący oddech, trudności w oddychaniu lub ucisk w klatce piersiowej;
- obrzęk powiek, twarzy lub ust;
- swędzenie całego ciała, zaczerwienienie skóry lub swędzące czerwone plamy;
- wysypki skórne;
- ciężkie reakcje skórne, takie jak wysypka z pęcherzami (może dotyczyć jamy ustnej i języka).
Zoloder może wpływać na wątrobę. Objawy problemów z wątrobą obejmują:
- zmęczenie;
- utrata apetytu;
- Wymiotował;
- zażółcenie skóry i białek oczu (żółtaczka).
Jeśli wystąpi którykolwiek z tych objawów, należy przerwać przyjmowanie leku Zoloder i natychmiast poinformować o tym lekarza.
Inne skutki uboczne:
Częste działania niepożądane (mogą wystąpić u 1 na 10 osób):
- bół głowy;
- rozstrój żołądka, biegunka, nudności, wymioty;
- wzrost wartości czynności wątroby w badaniach krwi;
- wysypki skórne.
Niezbyt częste działania niepożądane (mogą wystąpić u 1 na 100 osób):
- zmniejszenie liczby czerwonych krwinek, które może powodować bladość, osłabienie lub duszność;
- zmniejszony apetyt;
- bezsenność, senność;
- drgawki, zawroty głowy, uczucie zawrotów głowy, mrowienie, kłucie lub drętwienie;
- zmiana smaku;
- zaparcia, trudności w trawieniu, wzdęcia, suchość w ustach;
- ból mięśni;
- uszkodzenie wątroby i zażółcenie skóry i oczu (żółtaczka);
- obrzęk, pęcherze (pokrzywka), swędzenie, zwiększona potliwość;
- zmęczenie, ogólne złe samopoczucie, gorączka.
Rzadkie działania niepożądane (mogą wystąpić u 1 na 1000 osób):
- niższy niż normalny poziom białych krwinek, które pomagają bronić się przed infekcjami oraz płytek krwi, które umożliwiają krzepnięcie krwi;
- zmiana zabarwienia skóry (czerwona lub fioletowa), która może być spowodowana zmniejszeniem liczby płytek krwi, innymi zmianami w komórkach krwi;
- zmiany w składzie chemicznym krwi (wysoki poziom cholesterolu, tłuszczu);
- niski poziom potasu we krwi;
- dreszcze;
- zmieniony elektrokardiogram (EKG), zmiana rytmu i częstości akcji serca;
- niewydolność wątroby;
- reakcje alergiczne (czasami ciężkie), w tym wysypka z rozległymi pęcherzami i łuszczeniem się skóry, ciężkie reakcje skórne, obrzęk ust i twarzy;
- wypadanie włosów.
Zgłaszanie skutków ubocznych
Jeśli wystąpią jakiekolwiek objawy niepożądane, w tym wszelkie możliwe działania niepożądane niewymienione w tej ulotce, należy porozmawiać z lekarzem lub farmaceutą. Działania niepożądane można również zgłaszać bezpośrednio za pośrednictwem krajowego systemu zgłaszania pod adresem https://www.aifa.gov.it/content/segnalazioni-reazioni-avverse.Zgłaszanie działań niepożądanych może pomóc w uzyskaniu dodatkowych informacji na temat bezpieczeństwa tego leku.
Wygaśnięcie i przechowywanie
Lek należy przechowywać w miejscu niewidocznym i niedostępnym dla dzieci. Nie stosować tego leku po upływie terminu ważności zamieszczonego na etykiecie po EXP.Termin ważności oznacza ostatni dzień podanego miesiąca. Nie przechowywać w temperaturze powyżej 30°C.
Nie należy wyrzucać żadnych leków do kanalizacji ani domowych pojemników na odpadki. Należy zapytać farmaceutę, jak usunąć leki, których się już nie używa.Pomoże to chronić środowisko.
Skład i postać farmaceutyczna
Co zawiera lek Zoloder
- Substancją czynną jest flukonazol. Każda kapsułka twarda zawiera 100 mg, 150 mg lub 200 mg flukonazolu.
- Pozostałe składniki to: Zawartość kapsułki: laktoza jednowodna, skrobia żelowana, magnezu stearynian, krzemionka koloidalna bezwodna, laurylosiarczan sodu. Zawartość wieczka kapsułki: żelatyna, dwutlenek tytanu (E171), tlenek żelaza żółty (E172) (tylko w kapsułkach 100 mg).
Jak wygląda lek Zoloder i co zawiera opakowanie
Kapsułki twarde Zoloder 100 mg są żółte. Pudełko zawierające 10 kapsułek po 100 mg.
Kapsułki twarde Zoloder 150 mg są białe. Pudełko zawierające 2 kapsułki po 150 mg.
Kapsułki twarde Zoloder 200 mg są białe. Pudełko zawierające 7 kapsułek po 200 mg
Nie wszystkie rozmiary opakowań mogą być wprowadzone na rynek
Ulotka pakietu źródłowego: AIFA (Włoska Agencja Leków). Treść opublikowana w styczniu 2016 r. Przedstawione informacje mogą być nieaktualne.
Aby mieć dostęp do najbardziej aktualnej wersji, warto wejść na stronę AIFA (Włoskiej Agencji Leków). Zastrzeżenie i przydatne informacje.
01.0 NAZWA PRODUKTU LECZNICZEGO
KAPSUŁKI TWARDE ZOLODER
02.0 SKŁAD JAKOŚCIOWY I ILOŚCIOWY
Każda kapsułka twarda zawiera 100 mg flukonazolu
Substancje pomocnicze: Każda kapsułka twarda zawiera również 115 mg laktozy jednowodnej
Każda kapsułka twarda zawiera 150 mg flukonazolu
Substancje pomocnicze: Każda kapsułka twarda zawiera również 172,5 mg laktozy jednowodnej
Każda kapsułka twarda zawiera 200 mg flukonazolu
Substancje pomocnicze: Każda kapsułka twarda zawiera również 230 mg laktozy jednowodnej
Pełny wykaz substancji pomocniczych, patrz punkt 6.1.
03.0 POSTAĆ FARMACEUTYCZNA
Kapsułka twarda.
Twarda kapsułka żelatynowa 100 mg jest żółta. Rozmiar kapsułki to n. 2.
Twarda kapsułka żelatynowa 150 mg jest biała. Rozmiar kapsułki to n. 0.
Twarda kapsułka żelatynowa 200 mg jest biała. Rozmiar kapsułki to n. 0.
04.0 INFORMACJE KLINICZNE
04.1 Wskazania terapeutyczne
ZOLODER jest wskazany w następujących zakażeniach grzybiczych (patrz punkt 5.1).
ZOLODER jest wskazany u dorosłych w leczeniu:
• Kryptokokowe zapalenie opon mózgowo-rdzeniowych (patrz punkt 4.4).
• Kokcydioidomikoza (patrz punkt 4.4).
• Inwazyjna kandydoza.
• Kandydoza błon śluzowych, w tym kandydoza jamy ustnej i gardła, kandydoza przełyku, kandyduria i przewlekła kandydoza śluzówkowo-skórna.
• Przewlekła zanikowa kandydoza jamy ustnej (zapalenie protezy jamy ustnej), gdy higiena jamy ustnej i leczenie miejscowe są niewystarczające.
• Kandydoza pochwy, ostra lub nawracająca, gdy terapia miejscowa nie jest odpowiednia.
• Balanitis od Candida, gdy terapia miejscowa nie jest odpowiednia.
• dermatomykoza, w tym: tinea pedis, tinea corporis, tinea cruris, tinea versicolor i infekcje skóry od Candida, gdy wskazane jest leczenie systemowe.
• Tinea unguinium (grzybica paznokci), gdy inne metody leczenia nie są uważane za odpowiednie.
ZOLODER jest wskazany u dorosłych w profilaktyce::
• Nawrót kryptokokowego zapalenia opon mózgowych u pacjentów z wysokim ryzykiem nawrotu.
• Nawrót kandydozy jamy ustnej i gardła lub przełyku u pacjentów zakażonych wirusem HIV z wysokim ryzykiem nawrotu.
• Zmniejszenie częstości występowania nawracającej kandydozy pochwy (4 lub więcej epizodów rocznie).
• Profilaktyka kandydemii u pacjentów z przedłużającą się neutropenią (np. pacjenci ze złośliwymi chorobami układu krwiotwórczego poddawani chemioterapii lub pacjenci poddawani przeszczepieniu krwiotwórczych komórek macierzystych (patrz punkt 5.1)).
ZOLODER jest wskazany u noworodków urodzonych o czasie, niemowląt, niemowląt, dzieci i młodzieży w wieku od 0 do 17 lat:
ZOLODER stosuje się w leczeniu kandydozy błon śluzowych (lub gardła i przełyku), inwazyjnej kandydozy, kryptokokowego zapalenia opon mózgowych oraz w profilaktyce kandydozy u pacjentów z obniżoną odpornością.
ZOLODER może być stosowany jako leczenie podtrzymujące w celu zapobiegania nawrotom kryptokokowego zapalenia opon mózgowo-rdzeniowych u dzieci z wysokim ryzykiem nawrotu (patrz punkt 4.4).
Terapię można rozpocząć przed poznaniem wyników hodowli lub innych badań laboratoryjnych, ale gdy wyniki będą dostępne, należy odpowiednio dostosować leczenie przeciwinfekcyjne.
Należy wziąć pod uwagę oficjalne wytyczne dotyczące właściwego stosowania środków przeciwgrzybiczych.
04.2 Dawkowanie i sposób podawania
Dawkowanie
Dawkowanie powinno być uzależnione od charakteru i ciężkości zakażenia grzybiczego Leczenie zakażeń wymagających wielokrotnego dawkowania należy kontynuować do czasu, gdy parametry kliniczne lub inne badania laboratoryjne wykażą, że aktywne zakażenie grzybicze ustąpi. Nieodpowiedni okres leczenia może prowadzić do nawrotu aktywnej infekcji.
Dorośli ludzie
Populacje specjalne
Starsi mieszkańcy
Dawkę należy dostosować w zależności od czynności nerek (patrz "Zaburzenia czynności nerek").
Zaburzenia czynności nerek
Nie ma konieczności dostosowania podczas wykonywania terapii jednodawkowej. Jednak w przypadku stosowania wielokrotnych dawek flukonazolu u pacjentów z niewydolnością nerek (w tym w populacji pediatrycznej) należy podać dawkę początkową od 50 mg do 400 mg,
w oparciu o zalecaną dawkę dobową dla danego wskazania.Po tej początkowej dawce nasycającej dawkę dobową (w zależności od wskazania) należy dostosować zgodnie z następującym schematem:
Pacjenci poddawani regularnej dializie powinni otrzymywać 100% zalecanej dawki po każdej sesji dializy; w dni bez dializy pacjenci powinni otrzymywać zmniejszoną dawkę na podstawie klirensu kreatyniny.
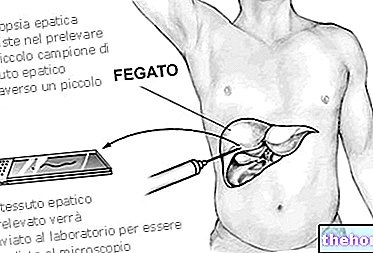
Zaburzenia czynności wątroby
Dostępne są ograniczone dane dotyczące pacjentów z zaburzeniami czynności wątroby, dlatego flukonazol należy stosować ostrożnie u pacjentów z zaburzeniami czynności wątroby (patrz punkty 4.4 i 4.8).
Populacja pediatryczna
W populacji pediatrycznej nie należy przekraczać maksymalnej dawki 400 mg/dobę. Podobnie jak w przypadku podobnych zakażeń u dorosłych, czas trwania leczenia zależy od odpowiedzi klinicznej i mikologicznej. ZOLODER podaje się w pojedynczej dawce dobowej.
Dzieci i młodzież z zaburzeniami czynności nerek, patrz dawkowanie w punkcie „Zaburzenia czynności nerek”. Nie badano farmakokinetyki flukonazolu u dzieci i młodzieży z niewydolnością nerek (w przypadku „noworodków urodzonych o czasie”, u których często występuje głównie niedojrzałość nerek, patrz poniżej).
Niemowlęta, niemowlęta i dzieci (od 28 dni do 11 lat):
Młodzież (od 12 do 17 lat):
Na podstawie masy ciała i okresu dojrzewania lekarz będzie musiał ocenić, które dawkowanie jest najbardziej odpowiednie (dorośli czy dzieci). Dane kliniczne wskazują, że dzieci mają wyższy klirens flukonazolu niż u dorosłych. Dawka 100 200 i 400 mg u dorosłych odpowiada dawce 3,6 i 12 mg/kg u dzieci, aby osiągnąć porównywalną „ekspozycja ogólnoustrojowa”.
Bezpieczeństwo i skuteczność wskazania kandydoza narządów płciowych u dzieci i młodzieży nie zostały ustalone. Obecnie dostępne dane dotyczące bezpieczeństwa dla innych wskazań pediatrycznych opisano w punkcie 4.8. W przypadkach, w których leczenie kandydozy narządów płciowych u młodzieży (12 do 17 lat) jest absolutnie konieczne, dawkowanie powinno być takie samo jak u dorosłych.
Niemowlęta donoszone (0 do 27 dni):
Wydalanie flukonazolu u noworodków zachodzi powoli.Niewiele jest danych farmakokinetycznych potwierdzających to dawkowanie u noworodków urodzonych w terminie (patrz punkt 5.2).
Sposób podawania
ZOLODER można podawać doustnie lub we wlewie dożylnym, w zależności od stanu klinicznego pacjenta. W przypadku zmiany dawki z dożylnej na doustną lub odwrotnie nie jest konieczna zmiana dawki dobowej.
Kapsułki należy połykać w całości i niezależnie od przyjmowanego pokarmu.
04.3 Przeciwwskazania
Nadwrażliwość na substancję czynną, pokrewne związki azolowe lub na którąkolwiek substancję pomocniczą
(patrz punkt 6.1).
Jednoczesne podawanie terfenadyny jest przeciwwskazane u pacjentów otrzymujących wielokrotną terapię preparatem ZOLODER w dawce ≥400 mg/dobę na podstawie wyników badania interakcji po podaniu wielokrotnym. Jednoczesne podawanie innych leków, które wydłużają odstęp QT i są metabolizowane przez cytochrom P450 (CYP) 3A4, takich jak cyzapryd, astemizol, pimozyd, chinidyna i erytromycyna, jest przeciwwskazane u pacjentów leczonych flukonazolem (patrz punkty 4.4 i 4.5).
04.4 Specjalne ostrzeżenia i odpowiednie środki ostrożności dotyczące stosowania
Grzybica skóry
Flukonazol był badany w leczeniu: grzybica skóry głowy u dzieci. Wykazano, że nie jest lepszy od gryzeofulwiny i że ogólny wskaźnik powodzenia wynosił mniej niż 20%, dlatego ZOLODER nie powinien być stosowany do grzybica skóry głowy.
Kryptokokoza
Dowody na skuteczność flukonazolu w leczeniu kryptokokozy innych miejsc (np. kryptokokozy skóry i płuc) są ograniczone, dlatego nie są możliwe zalecenia dotyczące dawkowania.
Głębokie endemiczne grzybice
Dowody na skuteczność flukonazolu w leczeniu głęboko endemicznych grzybic, takich jak parakokcydioidomikoza, sporotrychoza limfatyczna i histoplazmoza, są ograniczone i dlatego nie są możliwe zalecenia dotyczące dawkowania.
Układ nerkowy
Produkt ZOLODER należy podawać ostrożnie pacjentom z zaburzeniami czynności nerek (patrz punkt 4.2).
Układ wątrobowo-żółciowy
ZOLODER należy stosować ostrożnie u pacjentów z zaburzeniami czynności wątroby
(patrz punkt 4.2).
ZOLODER był związany z rzadkimi przypadkami ciężkiej toksyczności wątroby, czasami śmiertelnymi, zwłaszcza u pacjentów z ciężką chorobą podstawową. W przypadkach hepatotoksyczności związanej z flukonazolem nie było możliwe ustalenie związku z stosowaną dawką dobową, czasem trwania leczenia, płcią lub wiekiem pacjenta.Hepatotoksyczność flukonazolu była na ogół odwracalna po przerwaniu leczenia.
Pacjenci z zaburzeniami czynności wątroby podczas leczenia flukonazolem powinni być uważnie obserwowani pod kątem możliwego wystąpienia cięższego uszkodzenia wątroby.
Pacjentów należy poinformować o objawach wskazujących na ciężki wpływ na wątrobę (znaczna astenia,
jadłowstręt, uporczywe nudności, wymioty i żółtaczka). Leczenie flukonazolem należy natychmiast przerwać, a pacjent powinien skonsultować się z lekarzem.
Układu sercowo-naczyniowego
Niektóre azole, w tym flukonazol, były związane z wydłużeniem odstępu QT na elektrokardiogramie. W fazie po wprowadzeniu produktu do obrotu u pacjentów przyjmujących preparat ZOLODER wystąpiły bardzo rzadkie przypadki wydłużenia odstępu QT i torsades de pointes, w tym ciężko chorych pacjentów z wieloma współistniejącymi czynnikami ryzyka, takimi jak strukturalna choroba serca, nieprawidłowości, elektrolity i jednocześnie stosowane leki, które mogło przyczynić się do zaburzeń rytmu.
ZOLODER należy stosować ostrożnie u pacjentów z tymi potencjalnymi stanami proarytmicznymi. Jednoczesne podawanie innych produktów leczniczych, które wydłużają odstęp QT i które są metabolizowane przez cytochrom P450 (CYP) 3A4 jest przeciwwskazane (patrz punkty 4.3 i 4.5).
Halofantryna
Wykazano, że halofantryna w zalecanej dawce terapeutycznej wydłuża odstęp QTc i jest substratem CYP3A4.W związku z tym nie zaleca się jednoczesnego stosowania flukonazolu i halofantryny (patrz punkt 4.5).
Reakcje dermatologiczne
Podczas leczenia flukonazolem występowały rzadkie epizody skórnych reakcji złuszczających, takich jak zespół Stevensa-Johnsona i martwica toksyczno-rozpływna naskórka. Pacjenci z AIDS są bardziej podatni na wystąpienie ciężkich reakcji skórnych na wiele leków. Jeśli u pacjenta otrzymującego flukonazol z powodu powierzchownych zakażeń grzybiczych wystąpi wysypka skórna związana z flukonazolem, należy przerwać leczenie tym produktem leczniczym. Jeśli u pacjentów z inwazyjnymi / ogólnoustrojowymi zakażeniami grzybiczymi wystąpi wysypka skórna, należy ich uważnie obserwować i przerwać leczenie flukonazolem w przypadku pojawienia się zmian pęcherzowych lub rumienia wielopostaciowego.
Nadwrażliwość
W rzadkich przypadkach zgłaszano anafilaksję (patrz punkt 4.3).
Cytochrom P450
Flukonazol silnie hamuje cytochrom CYP2C9 i umiarkowanie hamuje cytochrom CYP3A4. Flukonazol hamuje również cytochrom CYP2C19. Należy monitorować pacjentów leczonych produktem leczniczym ZOLODER, którzy są jednocześnie leczeni produktami leczniczymi o wąskim oknie terapeutycznym i metabolizowanymi przez CYP2C9, CYP2C19 i CYP3A4 (patrz punkt 4.5).
Terfenadyna
Należy uważnie monitorować jednoczesne podawanie flukonazolu w dawkach poniżej 400 mg/dobę i terfenadyny (patrz punkty 4.3 i 4.5).
Substancje pomocnicze
Kapsułki zawierają laktozę jednowodną. Pacjenci z rzadką dziedziczną nietolerancją galaktozy, niedoborem laktazy lub zespołem złego wchłaniania glukozy-galaktozy nie powinni przyjmować tego leku.
04.5 Interakcje z innymi produktami leczniczymi i inne formy interakcji
Jednoczesne stosowanie następujących produktów leczniczych jest przeciwwskazane:
cyzaprydU pacjentów otrzymujących jednocześnie flukonazol i cyzapryd zgłaszano przypadki zdarzeń sercowych, w tym torsades de pointes. W kontrolowanym badaniu stwierdzono, że jednoczesne podawanie 200 mg flukonazolu raz na dobę i 20 mg cyzaprydu cztery razy na dobę prowadzi do znacznego zwiększenia stężenia cyzaprydu w osoczu i wydłużenia odstępu QTc Jednoczesne podawanie cyzaprydu i flukonazolu jest przeciwwskazane (patrz punkt 4.3).
TerfenadynaPrzeprowadzono badania interakcji po wystąpieniu ciężkich zaburzeń rytmu serca po wydłużeniu odstępu QTc u pacjentów otrzymujących inne azolowe leki przeciwgrzybicze i terfenadynę W badaniu przeprowadzonym z zastosowaniem dawki dobowej 200 mg flukonazolu nie wykazano wydłużenia odstępu QTc. Inne badanie z dobowymi dawkami flukonazolu 400 mg i 800 mg wykazało, że jednoczesne podawanie flukonazolu w dawkach 400 mg/dobę lub wyższych znacząco zwiększało stężenie terfenadyny w osoczu. Jednoczesne stosowanie flukonazolu w dawkach 400 mg/dobę lub wyższych i terfenadyny jest przeciwwskazane (patrz punkt 4.3).Należy ściśle monitorować jednoczesne stosowanie flukonazolu w dawkach poniżej 400 mg/dobę i terfenadyny.
Astemizol: Jednoczesne stosowanie flukonazolu i astemizolu może zmniejszać klirens astemizolu. Wynikający z tego wzrost stężenia astemizolu w osoczu może prowadzić do wydłużenia odstępu QT i występowania rzadkich przypadków torsade de pointes. Jednoczesne podawanie flukonazolu i astemizolu jest przeciwwskazane (patrz punkt 4.3).
Pimozyd: Chociaż nie był badany in vitro lub in vivo, jednoczesne podawanie flukonazolu i pimozydu może spowodować zahamowanie metabolizmu pimozydu, co może prowadzić do wydłużenia odstępu QT i rzadkich przypadków torsade de pointes. Jednoczesne podawanie flukonazolu i pimozydu jest przeciwwskazane (patrz punkt 4.3).
Chinidyna: Chociaż nie był badany in vitro lub in vivo, jednoczesne stosowanie flukonazolu i chinidyny może spowodować zahamowanie metabolizmu chinidyny.Stosowanie chinidyny wiąże się z wydłużeniem odstępu QT i występowaniem rzadkich przypadków torsade de pointes.Jednoczesne podawanie flukonazolu i chinidyny jest przeciwwskazane (patrz pkt 4.3).
Erytromycyna: Jednoczesne stosowanie flukonazolu i erytromycyny może zwiększyć ryzyko kardiotoksyczności (wydłużenie odstępu QT, zaburzenia typu torsade de pointes), a tym samym nagłej śmierci sercowej. Jednoczesne podawanie flukonazolu i erytromycyny jest przeciwwskazane (patrz punkt 4.3).
Nie zaleca się jednoczesnego stosowania następujących produktów leczniczych:
Halofantryna: Flukonazol może zwiększać stężenie halofantryny w osoczu ze względu na hamujący wpływ na CYP3A4. Jednoczesne stosowanie flukonazolu i halofantryny może zwiększyć ryzyko kardiotoksyczności (wydłużenie odstępu QT, torsades de pointes), a tym samym nagłej śmierci sercowej. Dlatego należy unikać jednoczesnego stosowania tych dwóch leków (patrz punkt 4.4).
Jednoczesne stosowanie następujących produktów leczniczych wymaga środków ostrożności i dostosowania dawki:
Wpływ innych produktów leczniczych na flukonazol
Ryfampicyna: Jednoczesne podawanie flukonazolu i ryfampicyny skutkowało zmniejszeniem AUC o 25% i zmniejszeniem okresu półtrwania flukonazolu o 20%. Dlatego u pacjentów przyjmujących jednocześnie ryfampicynę należy rozważyć zwiększenie dawki flukonazolu.
Badania interakcji wykazały, że nie występują klinicznie istotne zmiany we wchłanianiu flukonazolu podczas jednoczesnego podawania flukonazolu z pokarmem, cymetydyną, lekami zobojętniającymi sok żołądkowy lub po napromieniowaniu całego ciała w celu przeszczepienia szpiku kostnego.
Wpływ flukonazolu na inne produkty lecznicze
Flukonazol jest silnym inhibitorem izoenzymu 2C9 cytochromu P450 (CYP) i umiarkowanym inhibitorem izoenzymu CYP3A4. Flukonazol jest również inhibitorem izoenzymu CYP2CI9. Oprócz obserwowanych/udokumentowanych interakcji wymienionych poniżej, istnieje ryzyko zwiększonego stężenia w osoczu innych związków metabolizowanych przez izoenzymy CYP2C9 i CYP3A4 podawanych w skojarzeniu z flukonazolem.W związku z tym należy zachować dużą ostrożność Podczas przepisywania tych leków skojarzonych i ścisłej obserwacji pacjentów hamujące działanie flukonazolu na enzym utrzymuje się 4-5 dni po przerwaniu leczenia ze względu na długi okres półtrwania flukonazolu (patrz punkt 4.3).
Alfentanyl: Podczas jednoczesnego leczenia dożylnym flukonazolem (400 mg) i dożylnym alfentanylem (20 μg/kg) u zdrowych ochotników, AUC alfentanylu podwoiło się, prawdopodobnie z powodu hamowania CYP3A4. Może być konieczne dostosowanie dawki.
Amitryptylina, nortryptylina: Flukonazol nasila działanie amitryptyliny i nortryptyliny. Tam
5-nortryptylinę i (lub) S-amitryptylinę można oznaczyć na początku leczenia skojarzonego i po tygodniu leczenia.W razie potrzeby należy dostosować dawkę amitryptyliny/nortryptyliny.
Amfoterycyna B: Jednoczesne podawanie flukonazolu i amfoterycyny B zakażonym myszom normalnym iz obniżoną odpornością dało następujące wyniki: łagodne addytywne działanie przeciwgrzybicze w ogólnoustrojowych zakażeniach C. albicany, brak interakcji w zakażeniach wewnątrzczaszkowych z kryptokoki neoformanie, i antagonizm tych dwóch leków w zakażeniach ogólnoustrojowych od A. fumigatus. Kliniczne znaczenie wyników uzyskanych w tych badaniach nie jest znane.
Antykoagulanty: Po wprowadzeniu produktu do obrotu, podobnie jak w przypadku innych azolowych leków przeciwgrzybiczych, zgłaszano epizody krwawienia (stłuczenia, krwawienie z nosa, krwawienia z przewodu pokarmowego, krwiomocz i smoliste stolce) w związku z wydłużeniem czasu protrombinowego u pacjentów otrzymujących jednocześnie flukonazol i warfarynę. flukonazolem i warfaryną, czas protrombinowy wydłużył się dwukrotnie, prawdopodobnie z powodu hamowania metabolizmu warfaryny przez CYP2C9. U pacjentów otrzymujących jednocześnie leki przeciwzakrzepowe z grupy kumaryny i flukonazol należy dokładnie monitorować czas protrombinowy. Może być również konieczne dostosowanie dawki warfaryny.
Benzodiazepiny (szybkie działanie), np. midazolam, triazolamPo jednoczesnym podaniu midazolamu doustnie i flukonazolu zaobserwowano istotne zwiększenie stężenia midazolamu i jego efektów psychomotorycznych. Jednoczesne przyjmowanie 200 mg flukonazolu i 7,5 mg midazolamu doustnie zwiększało AUC i okres półtrwania midazolamu odpowiednio 3,7- i 2,2-krotnie. czas życia triazolamu odpowiednio 4,4 i 2,3 razy.Podczas jednoczesnego leczenia flukonazolem obserwowano nasilenie i wydłużenie działania triazolamu.Gdy konieczne jest jednoczesne leczenie benzodiazepinami u pacjentów otrzymujących flukonazol, należy zmniejszyć dawkę benzodiazepin i odpowiednio monitorować stan pacjenta. uważany za.
Karbamazepina: Flukonazol hamuje metabolizm karbamazepiny i zaobserwowano 30% wzrost stężenia karbamazepiny w surowicy. Istnieje ryzyko wystąpienia toksycznego działania karbamazepiny. Może być konieczne dostosowanie dawki karbamazepiny w zależności od pomiarów i (lub) wpływu stężeń.
Blokery kanału wapniowegoNiektóre blokery kanału wapniowego (nifedypina, izradypina, amlodypina, werapamil i felodypina) są metabolizowane przez CYP3A4. Flukonazol może zwiększać ogólnoustrojową ekspozycję na blokery kanału wapniowego Zaleca się częste monitorowanie pod kątem zdarzeń niepożądanych.
Celekoksyb: Podczas jednoczesnego leczenia flukonazolem (200 mg/dobę) i celekoksybem (200 mg), Cmax i AUC celekoksybu wzrosły odpowiednio o 68% i 134%.W połączeniu z flukonazolem, dawka celekoksybu.
Cyklofosfamid: Jednoczesne leczenie cyklofosfamidem i flukonazolem powoduje wzrost stężenia bilirubiny w surowicy i kreatyniny w surowicy. Oba leki można stosować łącznie, pod warunkiem uwzględnienia ryzyka związanego ze wzrostem stężenia bilirubiny i kreatyniny w surowicy.
FentanylZgłoszono śmiertelny przypadek zatrucia fentanylem z powodu możliwej interakcji między fentanylem i flukonazolem.Ponadto stwierdzono, że flukonazol znacznie opóźniał eliminację fentanylu u zdrowych ochotników. Wysokie stężenia fentanylu mogą prowadzić do depresji oddechowej. Pacjenci powinni być uważnie obserwowani pod kątem potencjalnego ryzyka depresji oddechowej. Może być konieczne dostosowanie dawki fentanylu.
Inhibitory reduktazy HMG-CoARyzyko miopatii i rabdomiolizy jest zwiększone, gdy flukonazol jest podawany jednocześnie z inhibitorami reduktazy HMG-CoA metabolizowanymi przez CYP3A4, takimi jak atorwastatyna i symwastatyna, lub CYP2C9, takimi jak fluwastatyna. Jeśli konieczne jest jednoczesne podawanie, należy monitorować pacjenta, ponieważ mogą pojawić się objawy miopatii i rabdomiolizy, oraz monitorować kinazę kreatyninową. Podawanie inhibitorów reduktazy HMG-CoA należy przerwać w przypadku stwierdzenia istotnego wzrostu kinazy kreatyninowej lub rozpoznania lub podejrzenia miopatii lub rabdiomiolizy.
Leki immunosupresyjne (np. cyklosporyna, ewerolimus, sirolimus i takrolimus):
Cyklosporyna: Flukonazol znacząco zwiększa stężenie i AUC cyklosporyny.Podczas jednoczesnego leczenia flukonazolem 200 mg/dobę i cyklosporyną (2,7 mg/kg/dobę) wystąpił wzrost o 1,8 AUC cyklosporyny. Oba leki można stosować w połączeniu, zmniejszając dawkę cyklosporyny w oparciu o stężenie samej cyklosporyny.
Ewerolimus: Chociaż żadne badania nie są dostępne in vivo lub in vitro, flukonazol może zwiększać stężenie ewerolimusu w surowicy poprzez hamowanie CYP3A4.
Syrolimus: Flukonazol zwiększa stężenie sirolimusa w osoczu, prawdopodobnie hamując metabolizm syrolimusa za pośrednictwem CYP3A4 i glikoproteiny P. Oba leki można stosować w połączeniu z dostosowaniem dawki sirolimusa w oparciu o analizę efektu/stężenia.
Takrolimus: Flukonazol może nawet 5-krotnie zwiększać stężenie w surowicy takrolimusu podawanego doustnie z powodu hamowania metabolizmu takrolimusu przez CYP3A4 w jelicie. Nie stwierdzono istotnych zmian farmakokinetycznych po dożylnym podaniu takrolimusu. Podwyższone stężenia takrolimusu były związane z nefrotoksycznością. Dawkę takrolimusu podawanego doustnie należy zmniejszyć w oparciu o stężenie samego takrolimusu.
Losartan: Flukonazol hamuje metabolizm losartanu do jego aktywnego metabolitu (E-31 74), co stanowi podstawę działania antagonisty receptora angiotensyny II występującego podczas leczenia losartanem. Pacjenci powinni być stale monitorowani pod kątem ciśnienia krwi.
Metadon: Flukonazol może zwiększać stężenie metadonu w surowicy. Może być konieczne dostosowanie dawki metadonu.
Niesteroidowe leki przeciwzapalne (NLPZ): Cmax i AUC flurbiprofenu zwiększyły się odpowiednio o 23% i 81% w przypadku podawania w skojarzeniu z flukonazolem w porównaniu z podawaniem samego flurbiprofenu. Podobnie, Cmax i „AUC farmakologicznie czynnego izomeru [S-(+)-ibuprofenu] wzrosły odpowiednio o 15% i 82%, gdy flukonazol podawano w skojarzeniu z racemicznym ibuprofenem (400 mg) w porównaniu z podawaniem sam racemiczny ibuprofen.
Chociaż nie przeprowadzono żadnych specjalnych badań, flukonazol może zwiększać ogólnoustrojową ekspozycję na inne NLPZ metabolizowane przez CYP2C9 (np. naproksen, lomoksykam, meloksykam, diklofenak) Zaleca się częste monitorowanie działań niepożądanych i toksyczności związanej z NLPZ.
Może być konieczne dostosowanie dawkowania NLPZ.
Fenytoina: Flukonazol hamuje metabolizm wątrobowy fenytoiny. Wielokrotne jednoczesne podawanie 200 mg flukonazolu i 250 mg fenytoiny dożylnie powodowało 75% wzrost AUC24 i 128% Cmin fenytoiny.W przypadku równoczesnego podawania należy monitorować stężenie fenytoiny w surowicy, aby uniknąć toksycznego działania fenytoiny.
Prednizon: Zgłoszono przypadek pacjenta po przeszczepieniu wątroby, otrzymującego prednizon, u którego wystąpiła ostra niewydolność kory nadnerczy po przerwaniu trzymiesięcznego leczenia flukonazolem CYP3A4, co doprowadziło do zwiększonego metabolizmu prednizonu Należy uważnie obserwować pacjentów leczonych przez długi czas flukonazolem i prednizonem monitorować pod kątem możliwej niewydolności kory nadnerczy po odstawieniu flukonazolu.
Ryfabutin: Flukonazol zwiększa stężenie ryfabutyny w surowicy, powodując zwiększenie AUC ryfabutyny nawet o 80%. Zgłaszano przypadki zapalenia błony naczyniowej oka u pacjentów otrzymujących jednocześnie flukonazol i ryfabutynę. Dlatego w leczeniu skojarzonym należy brać pod uwagę objawy toksyczności ryfabutyny.
Sakwinawir: Flukonazol zwiększa AUC i Cmax sakwinawiru odpowiednio o około 50% i 55%, ze względu na hamowanie metabolizmu wątrobowego sakwinawiru przez CYP3A4 i hamowanie glikoproteiny P. Interakcje z sakwinawirem/rytonawirem nie były badane i mogą być bardziej nasilone. Może być konieczne dostosowanie dawki sakwinawiru.
SulfonylomocznikiFlukonazol podawany zdrowym ochotnikom powodował wydłużenie okresu półtrwania w surowicy jednocześnie podawanych doustnie sulfonylomoczników (chlorpropamid, glibenklamid, glipizyd i tolbutamid). dawkowanie.
Teofilina: W kontrolowanym placebo badaniu interakcji podawanie 200 mg flukonazolu przez 14 dni powodowało 18% zmniejszenie średniego klirensu osoczowego teofiliny. Pacjenci leczeni dużymi dawkami teofiliny lub ze zwiększonym ryzykiem epizodów toksyczności indukowanej teofiliną powinni być ściśle monitorowani pod kątem objawów toksyczności teofiliny podczas jednoczesnego przyjmowania flukonazolu, a leczenie należy odpowiednio dostosować, jeśli takie objawy wystąpią.
Alkaloidy Vinca: Chociaż nie przeprowadzono żadnych specjalnych badań, flukonazol może zwiększać stężenie alkaloidów barwinka (np. winkrystyny i winblastyny) w osoczu, powodując neurotoksyczność, co jest możliwe dzięki hamującemu wpływowi na CYP3A4.
Witamina A: W opisanym przypadku u pacjenta leczonego jednocześnie kwasem all-trans-retinowym (kwasowa forma witaminy A) i flukonazolem wystąpiły działania niepożądane związane z ośrodkowym układem nerwowym w postaci guz rzekomy mózgu, które ustąpiły po przerwaniu leczenia flukonazolem.Dwa leki można stosować w skojarzeniu, ale należy wziąć pod uwagę występowanie działań niepożądanych związanych z ośrodkowym układem nerwowym.
Worykonazol: (inhibitory CYP2C9 i CYP3A4): Jednoczesne podawanie doustne worykonazolu (400 mg co 12 godzin przez 1 dzień, następnie 200 mg co 12 godzin przez 2,5 dnia) i flukonazolu doustnego (400 mg pierwszego dnia, następnie 200 mg co 24 godziny przez 4 dni) u 8 zdrowych mężczyzn spowodował zwiększenie Cmax i AUC worykonazolu odpowiednio o średnio 57% (90% CI: 20%, 107%) i 79% (90% CI: 40%, 128%) Nie określono które zmniejszenie dawki i (lub) częstości podawania worykonazolu i flukonazolu mogłoby wyeliminować to działanie. Jeśli worykonazol jest stosowany kolejno po flukonazolu, zaleca się monitorowanie działań niepożądanych związanych z worykonazolem.
Zydowudyna: Flukonazol zwiększa Cmax i AUC zydowudyny o 84% i
74%, ze względu na około 45% zmniejszenie klirensu zydowudyny. Podobnie okres półtrwania zydowudyny wydłużył się o około 128% po jednoczesnym podaniu z flukonazolem.Pacjentów poddawanych temu leczeniu skojarzonemu należy monitorować pod kątem możliwego wystąpienia działań niepożądanych związanych z zydowudyną. Można również rozważyć możliwość zmniejszenia dawek zydowudyny.
AzytromycynaOtwarte, randomizowane, trójramienne badanie krzyżowe z udziałem 18 zdrowych ochotników określiło wpływ pojedynczej doustnej dawki 1200 mg azytromycyny na farmakokinetykę pojedynczej doustnej dawki 800 mg flukonazolu, jak również wpływ flukonazolu na farmakokinetykę. Nie stwierdzono istotnych interakcji farmakokinetycznych między flukonazolem a azytromycyną.
Doustne środki antykoncepcyjne: Przeprowadzono dwa badania farmakokinetyczne z terapią skojarzoną z doustnymi środkami antykoncepcyjnymi podawanymi w skojarzeniu z wielokrotnymi dawkami flukonazolu. Nie stwierdzono istotnego wpływu na poziomy obu hormonów u pacjentów otrzymujących flukonazol 50 mg, natomiast AUC etynyloestradiolu i lewonorgestrelu w grupie przyjmującej flukonazol 200 mg/dobę wykazywało wzrost odpowiednio o 40% i 24%. wielokrotnych dawek flukonazolu w tych dawkach nie zmienia skuteczności złożonej doustnej terapii antykoncepcyjnej.
04.6 Ciąża i laktacja
Ciąża
Dane pochodzące od kilkuset ciężarnych kobiet leczonych standardowymi dawkami flukonazolu (w pierwszym trymestrze nie wykazały działań niepożądanych u płodu. U niemowląt, których matki otrzymywały duże dawki flukonazolu (400-800 mg/mc) z powodu kokcydioidomikozy przez okres ≥3 miesięcy, zgłoszono wiele wrodzonych anomalii (w tym brachycefalię, dysplazję ucha, olbrzymie ciemiączko przednie, skrzywienie kości udowej i synostoza kości ramiennej).
Badania na zwierzętach wykazały szkodliwy wpływ na reprodukcję (patrz punkt 5.3).
Flukonazolu w standardowych dawkach i przez krótki okres leczenia nie należy stosować w okresie ciąży, chyba że jest to bezwzględnie konieczne.
Flukonazol w dużych dawkach i (lub) przez dłuższy okres leczenia należy stosować w okresie ciąży wyłącznie w przypadku zakażeń zagrażających życiu.
Czas karmienia
Flukonazol przenika do mleka matki i osiąga stężenia poniżej poziomu w osoczu. Karmienie piersią można kontynuować po podaniu standardowej pojedynczej dawki flukonazolu 200 mg lub mniej.Karmienie piersią nie jest zalecane po wielokrotnym stosowaniu lub po podaniu dużych dawek flukonazolu.
Płodność
Flukonazol nie miał wpływu na płodność samców i samic szczurów (patrz punkt 5.3).
04.7 Wpływ na zdolność prowadzenia pojazdów i obsługiwania maszyn
Nie przeprowadzono badań dotyczących wpływu leku ZOLODER na zdolność prowadzenia pojazdów i obsługiwania maszyn. Należy pouczyć pacjentów, że podczas leczenia produktem leczniczym ZOLODER mogą czasami wystąpić zawroty głowy lub drgawki (patrz punkt 4.8) i nie powinni prowadzić pojazdów ani obsługiwać maszyn, jeśli wystąpi którykolwiek z tych objawów.
04.8 Działania niepożądane
Najczęściej zgłaszanymi działaniami niepożądanymi (>1/10) są bóle głowy, bóle brzucha, biegunka, nudności, wymioty, zwiększona aktywność aminotransferazy alaninowej, aminotransferazy asparaginianowej, zwiększona fosfataza zasadowa i wysypka.
Następujące działania niepożądane były obserwowane i zgłaszane podczas leczenia flukonazolem, z następującą częstością: bardzo często (≥ 1 / 10); często (≥1/100,
Populacja pediatryczna
Rodzaj i częstość występowania działań niepożądanych oraz zmian laboratoryjnych obserwowanych w pediatrycznych badaniach klinicznych, z wyjątkiem wskazania w kandydozie narządów płciowych, są porównywalne z obserwowanymi u dorosłych.
04.9 Przedawkowanie
Istnieją doniesienia o przedawkowaniu produktu ZOLODER oraz o współistniejących omamach i zachowaniach paranoidalnych.
W razie przypadkowego przedawkowania może być konieczne leczenie objawowe (z „odpowiednim leczeniem podtrzymującym i ewentualnie płukaniem żołądka).
Flukonazol jest wydalany głównie z moczem; wymuszona diureza prawdopodobnie zwiększa szybkość eliminacji. 3-godzinna sesja hemodializy zmniejsza stężenie w osoczu o około 50%.
05.0 WŁAŚCIWOŚCI FARMAKOLOGICZNE
05.1 Właściwości farmakodynamiczne
Klasyfikacja ATC
Grupa farmakoterapeutyczna: leki przeciwgrzybicze do stosowania ogólnego, pochodne triazolu, kod ATC: J02AC01.
Mechanizm akcji
Flukonazol jest triazolowym środkiem przeciwgrzybiczym. Jego głównym mechanizmem działania jest hamowanie demetylacji 14-alfa-lanosterolu za pośrednictwem grzyba cytochromu P-450, niezbędnego etapu w biosyntezie grzybowego ergosterolu.
Akumulacja 14 alfa-metylosteroli jest związana z następczą utratą ergosterolu w błonie komórkowej grzyba i może być podstawą przeciwgrzybiczego działania flukonazolu.
Było oczywiste, że flukonazol jest bardziej selektywny dla enzymów cytochromu P-450 grzybów niż dla różnych układów enzymatycznych cytochromu P-450 ssaków.
Wykazano, że flukonazol 50 mg/dobę podawany do 28 dni nie zmienia stężenia testosteronu w osoczu u mężczyzn ani stężenia steroidów u kobiet w wieku rozrodczym. Flukonazol podawany w dawkach od 200 do 400 mg na dobę nie miał klinicznie istotnego wpływu na stężenie endogennych steroidów ani odpowiedź na stymulację ACTH u zdrowych ochotników płci męskiej. Badania interakcji z antypiryną wykazują, że flukonazol w dawce 50 mg lub w dawkach wielokrotnych nie zmienia jego metabolizmu.
Wrażliwość in vitro
In vitro, flukonazol wykazuje działanie przeciwgrzybicze na większość gatunków Kandyda klinicznie częściej (w tym C. albicany, C. parapsiloza, C. tropikalny). C. glabrata pokazuje „szeroki zakres czułości, podczas gdy C. krusei jest odporny na flukonazol.
Flukonazol również wykazuje aktywność in vitro do Cryptococcus neoformans I Cryptococcus gattoi a także wobec endemicznych drożdży Blastomyces dermatiditis, Coccidioides immitis, Histoplazma capsulatum I Paracoccidioides brasiliensis.
Zależność farmakokinetyczna / farmakodynamiczna (PK / PD)
W badaniach na zwierzętach istnieje korelacja między wartościami MIC a skutecznością wobec doświadczalnych grzybic ze względu na gatunek, który ma być Candida. W badaniach klinicznych istnieje zależność liniowa między AUC a dawką flukonazolu prawie 1: 1. Istnieje również bezpośrednia, aczkolwiek niedoskonała zależność między AUC lub dawką a skuteczną reakcją kliniczną na leczenie kandydozy jamy ustnej oraz, w mniejszym stopniu, kandydemia. Podobnie, gojenie jest mniej prawdopodobne w przypadku infekcji wywołanych przez szczepy o wyższym MIC flukonazolu.
Mechanizm(y) oporu
ten Kandyda spp rozwinęły pewne mechanizmy oporności na azolowe środki przeciwgrzybicze. Wiadomo, że szczepy grzybów, które rozwinęły jeden lub więcej z tych mechanizmów oporności, wykazują podwyższone wartości MIC dla flukonazolu, co ma negatywny wpływ na skuteczność. in vivo i na poziomie klinicznym.
Istnieją doniesienia o nadkażeniach gatunkami z Kandyda inne niż C. albicany, które są często z natury niewrażliwe na flukonazol (np. Candida krusei). W takich przypadkach może być wymagana alternatywna terapia przeciwgrzybicza.
Punkty przerwania (EUCAST)
Na podstawie analizy danych PK / PD, wrażliwość in vitro i odpowiedzi klinicznej, „EUCAST-AFST (Europejski Komitet ds. Badania Podatności na środki przeciwdrobnoustrojowe – podkomitet ds.
Badanie Wrażliwości na Przeciwgrzybicze) określiło wartości graniczne dla flukonazolu dla gatunków z Kandyda (Dokument racjonalny EUCAST Flukonazol - wersja 2).
Zostały one podzielone na wartości graniczne niezwiązane z gatunkiem, które zostały określone głównie na podstawie danych PK/PD i są niezależne od rozkładu wartości MIC dla poszczególnych gatunków, oraz wartości graniczne związane z gatunkami, dla gatunków najczęściej związanych z zakażeniami w „ man. Punkty przerwania są pokazane w poniższej tabeli:
S = Wrażliwe,
R = Odporny
A. = Wartości graniczne niezwiązane z gatunkiem zostały określone głównie na podstawie danych PK/PD i są niezależne od rozkładu wartości MIC dla poszczególnych gatunków. Są używane tylko w przypadku organizmów, które nie mają określonych punktów przerwania.
- = Test wrażliwości nie jest zalecany, ponieważ terapia lekowa nie jest najbardziej odpowiednia dla tego gatunku.
IE = Nie ma wystarczających dowodów na to, że terapia lekowa jest odpowiednia dla tego gatunku.
05.2 „Właściwości farmakokinetyczne
Właściwości farmakokinetyczne flukonazolu są podobne zarówno po podaniu dożylnym, jak i doustnym.
Wchłanianie
Podawać doustnie, ja! Flukonazol jest dobrze wchłaniany, a jego stężenie w osoczu (i ogólnoustrojowa biodostępność) przekracza 90% stężeń osiąganych po podaniu dożylnym.
Jednoczesne przyjmowanie pokarmu nie wpływa na wchłanianie po podaniu doustnym, a maksymalne stężenie w osoczu na czczo osiągane jest po okresie od 30 do 90 minut.
Stężenia w osoczu są proporcjonalne do podanych dawek.
90% poziomu stan stabilny osiąga się to po 4 lub 5 dniach powtarzanego podawania raz na dobę. Podanie dawki nasycającej (w dniu 1) równej dwukrotności normalnej dawki dobowej pozwala na osiągnięcie poziomu w osoczu prawie 90% poziomu stan stabilny już drugiego dnia.
Dystrybucja
Pozorna objętość dystrybucji jest porównywalna z całkowitą ilością wody w organizmie. Wiązanie z białkami osocza jest niskie (11-12%).
Flukonazol dobrze przenika do wszystkich badanych płynów organicznych. Stężenie flukonazolu w ślinie i plwocinie jest podobne do stężenia w osoczu.U pacjentów z grzybiczym zapaleniem opon mózgowo-rdzeniowych stężenie flukonazolu w płynie mózgowo-rdzeniowym wynosi około 1,80% odpowiedniego stężenia w osoczu.
Duże stężenia flukonazolu w skórze, powyżej stężenia w surowicy, osiągane są w warstwie rogowej naskórka, na poziomie naskórka i skóry właściwej oraz gruczołów potowych Flukonazol kumuluje się w warstwie rogowej naskórka Po zastosowaniu dawki 50 mg/dobę przez 12 dni a wykryto stężenie flukonazolu 73 mcg/g i 7 dni po przerwie
terapii poziom leku nadal wynosił 5,8 mcg/g. Po podaniu tygodniowej dawki 150 mg stężenie flukonazolu w warstwie rogowej naskórka w 7. dobie leczenia wynosiło 23,4 µg/g, a 7 dni po drugiej dawce stężenie flukonazolu nadal wynosiło 7,1 µg/g.
Po 4 miesiącach stosowania raz w tygodniu 150 mg flukonazolu stężenie flukonazolu wynosiło 4,05 mcg/g w zdrowych paznokciach i 1,8 mcg/g w chorych paznokciach. Ponadto flukonazol był nadal dostępny w próbkach paznokci 6 miesięcy po zakończeniu terapii.
Biotransformacja
Flukonazol jest metabolizowany tylko w niewielkim stopniu. Spośród dawki radioaktywnej tylko 11% jest wydalane w postaci zmodyfikowanej z moczem.Flukonazol jest selektywnym inhibitorem izoenzyn CYP2C9 i CYP3A4 (patrz punkt 4.5).Flukonazol jest również inhibitorem izoenzymu CYP2CI9.
Wydalanie
Okres półtrwania flukonazolu w osoczu wynosi około 30 h. Główną drogą eliminacji są nerki: około 1 „80% podanej dawki znajduje się w niezmienionej postaci w moczu. Klirens flukonazolu jest proporcjonalny do klirensu kreatyniny. Nie ma dowodów na krążące metabolity.
Długi okres półtrwania w fazie eliminacji z osocza stanowi podstawę jednodawkowej terapii kandydozy pochwy, raz na dobę i raz w tygodniu w innych wskazaniach.
Farmakokinetyka w niewydolności nerek
U pacjentów z ciężką niewydolnością nerek (GFR
Dlatego konieczne jest zmniejszenie dawki Flukonazol jest usuwany za pomocą hemodializy i, w mniejszym stopniu, dializy otrzewnowej. Po trzygodzinnej sesji hemodializy około 50% flukonazolu jest usuwane z krwi.
Farmakokinetyka u dzieci
Dane farmakokinetyczne zostały ocenione u 113 pacjentów pediatrycznych z 5 badań: 2 badania dawki pojedynczej, 2 badania dawki wielokrotnej i jedno badanie u wcześniaków. Dane z pierwszego badania nie mogły zostać zinterpretowane ze względu na zmiany sformułowań w trakcie badania. Dodatkowe dane pochodzą z badania współczucia.
Po podaniu flukonazolu w dawkach 2-8 mg/kg dzieciom w wieku od 9 miesięcy do 15 lat, dla dawek 1 mg/kg obserwowano AUC wynoszące około 38 mcg·h/ml. Średni okres półtrwania w fazie eliminacji flukonazolu z osocza wynosił od 15 do 18 godzin, a objętość dystrybucji po podaniu wielokrotnym wynosiła około 880 ml/kg.Dłuższy okres półtrwania w fazie eliminacji z osocza obserwowano po podaniu jednorazowym, około 24 godzin. jest porównywalny z okresem półtrwania flukonazolu w osoczu po jednorazowym podaniu dożylnym dawki 3 mg/kg dzieciom w wieku od 11 dni do 11 miesięcy. Objętość dystrybucji w tej grupie wiekowej wynosiła około 950 ml/kg.
Doświadczenie ze stosowaniem flukonazolu u noworodków ogranicza się do badań farmakokinetycznych u wcześniaków.Dla 12 wcześniaków w wieku ciążowym około 28 tygodni średni wiek po podaniu pierwszej dawki wynosił 24 godziny (zakres 9-36 godzin), a średnia masa urodzeniowa wynosiła 0,9 kg. (zakres 0,75-1,10 kg). Siedmiu pacjentów ukończyło protokół; maksymalnie pięć dożylnych dawek 6 mg/kg flukonazolu podawano co 72 godziny. Pierwszego dnia średni okres półtrwania wynosił 74 godziny (zakres 44-185), a następnie zmniejszył się w siódmym dniu do średniej wartości 53 godzin (zakres 30-131), aż do osiągnięcia trzynastego dnia. , wartość 47 godzin (zakres 27-68).W pierwszym dniu pole pod krzywą (mcg.h/ml) wynosiło 271 (zakres 173-385), by następnie wzrosnąć, w siódmym dniu, do wartość średnia 490 (zakres 292-734) i zamiast tego zmniejsza się w trzynastym dniu do średniej wartości 360 (zakres 167-566). W pierwszym dniu objętość dystrybucji (ml/kg) wynosiła 1183 (zakres 1070-1470), a następnie z czasem rosła, aby w siódmym dniu osiągnąć średnią wartość 1184 (zakres 510-2130) i 1328 (zakres zakres 1040-1680) trzynastego dnia.
Farmakokinetyka u osób starszych
Badanie farmakokinetyczne przeprowadzono z udziałem 22 osób w wieku 65 lat i starszych, którym podano pojedynczą dawkę doustną 50 mg flukonazolu. Dziesięć z tych osób otrzymywało jednocześnie leki moczopędne. Cmax 1,54 mcg/ml zarejestrowano 1,3 godziny po podaniu. Średnia wartość AUC wynosiła 76,4 ± 20,3 µg·h/ml, a średni okres półtrwania 46,2 godziny. Te wartości parametrów farmakokinetycznych są wyższe niż podobne wartości zgłaszane dla zdrowych młodych ochotników płci męskiej. Jednoczesne podawanie leków moczopędnych nie zmieniało znacząco wartości AUC ani Cmax, ponadto klirens kreatyniny (74 ml/min), odsetek niezmienionego leku w moczu (0-24 godz., 22%) oraz szacunkowe klirens nerkowy flukonazolu (0,124). ml/min/kg) u osób starszych były na ogół niższe niż u młodszych ochotników.
W związku z tym wydaje się, że zmienione zachowanie flukonazolu w organizmie pacjentów w podeszłym wieku ma związek z charakterystyczną dla tej grupy pacjentów obniżoną czynnością nerek.
05.3 Przedkliniczne dane o bezpieczeństwie
Działania w badaniach przedklinicznych obserwowano jedynie przy narażeniu uważanym za znacznie powyżej maksymalnego poziomu narażenia u ludzi, co wskazuje na niewielkie znaczenie w zastosowaniu klinicznym.
Karcynogeneza
Flukonazol nie wykazywał działania rakotwórczego u myszy i szczurów leczonych doustnie przez 24 miesiące w dawkach 2,5, 5 lub 10 mg/kg/dobę (około 2-7-krotność zalecanej dawki dla ludzi). / dzień stwierdzono zwiększoną częstość występowania gruczolaków wątrobowokomórkowych.
Zaburzenia płodności
Flukonazol nie wpływał na płodność samców i samic szczurów, którym podawano doustnie dawki dobowe 5,10-020 mg/kg lub dawki pozajelitowe 5, 25 lub 75 mg/kg.
Nie stwierdzono wpływu na płód przy dawkach 5 lub 10 mg/kg; przy dawkach równych lub większych niż 25 i 50 mg/kg obserwowano wzrost wariantów anatomicznych płodu (żebra nadliczbowe, poszerzenie miedniczek nerkowych) oraz opóźnienia w kostnieniu.W dawkach od 80 mg/kg do 320 mg/kg c „był wzrost śmiertelności zarodków u szczurów, a nieprawidłowości płodu obejmowały faliste żebra, rozszczep podniebienia i zaburzenia kostnienia twarzoczaszki”.
Początek porodu był nieznacznie opóźniony po podaniu doustnych dawek 20 mg/kg, a u niektórych ciężarnych szczurów po podaniu dożylnym dawki 20 mg/kg i 40 mg/kg obserwowano dystocję i wydłużenie porodu.
Po zaburzeniach porodu nastąpił niewielki wzrost liczby martwych urodzeń i spadek przeżywalności noworodków przy tych dawkach. Wpływ na przebieg porodu u szczurów jest zgodny z właściwościami zmniejszania poziomu estrogenów specyficznymi dla gatunku wywołanymi przez duże dawki flukonazolu.Nie wystąpiły takie zaburzenia hormonalne u kobiet leczonych flukonazolem (patrz punkt 5.1).
06.0 INFORMACJE FARMACEUTYCZNE
06.1 Zaróbki
Zawartość kapsułki:
Monohydrat laktozy
Skrobia wstępnie żelowana
Bezwodna krzemionka koloidalna
Stearynian magnezu
Laurylosiarczan sodu
Kapsuła:
galaretka
dwutlenek tytanu (E 171)
żółty tlenek żelaza (E 172) (tylko w kapsułkach 100 mg).
06.2 Niezgodność
Nieistotne.
06.3 Okres ważności
3 lata
06.4 Specjalne środki ostrożności przy przechowywaniu
Nie przechowywać w temperaturze powyżej 30°C.
06.5 Rodzaj opakowania bezpośredniego i zawartość opakowania
Kapsułki ZOLODER 100 mg: blister PVC/Al zawierający 10 kapsułek
Kapsułki ZOLODER 150 mg: blister PVC/Al zawierający 2 kapsułki
Kapsułki ZOLODER 200 mg: blister PVC/Al zawierający 7 kapsułek
Nie wszystkie rozmiary opakowań mogą być wprowadzone na rynek.
06.6 Instrukcje użytkowania i obsługi
Niewykorzystany lek i odpady pochodzące z tego leku należy usunąć zgodnie z lokalnymi przepisami.
07.0 PODMIOT POZWOLENIA NA DOPUSZCZENIE DO OBROTU
EFFIK ITALIA S.p.A Via Lincoln 7 / A 20092 Cinisello Balsamo, Mediolan
08.0 NUMER POZWOLENIA NA DOPUSZCZENIE DO OBROTU
Kapsułki twarde ZOLODER 100 mg: AIC n. 037662018
Kapsułki twarde ZOLODER 150 mg: AIC n. 037662020
Kapsułki twarde ZOLODER 200 mg: AIC n. 037662032
09.0 DATA PIERWSZEGO ZEZWOLENIA LUB PRZEDŁUŻENIA ZEZWOLENIA
18 kwietnia 2008
10.0 DATA ZMIAN TEKSTU
7 października 2012