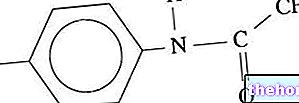
Składniki aktywne: Montelukast
MONTEGEN 5 mg tabletki do żucia
Ulotki informacyjne Montegen są dostępne dla wielkości opakowań:- MONTEGEN 10 mg tabletki powlekane
- MONTEGEN 5 mg tabletki do żucia
- MONTEGEN 4 mg tabletki do żucia
- MONTEGEN 4 mg granulat
Wskazania Dlaczego stosuje się Montegen? Po co to jest?
MONTEGEN jest antagonistą receptora leukotrienowego, który blokuje substancje zwane leukotrienami. Leukotrieny powodują zwężenie i obrzęk dróg oddechowych w płucach, a także powodują objawy alergiczne. Blokowanie leukotrienów łagodzi objawy astmy i pomaga ją kontrolować.
Lekarz przepisał MONTEGEN do leczenia astmy, aby zapobiegać objawom astmy zarówno w dzień, jak i w nocy.
- MONTEGEN stosuje się w leczeniu pacjentów, którzy nie są odpowiednio kontrolowani za pomocą leków i potrzebują dodatkowych leków.
- MONTEGEN może być również stosowany jako alternatywa dla wziewnych kortykosteroidów u pacjentów w wieku od 6 do 14 lat, którzy niedawno nie przyjmowali doustnych kortykosteroidów na astmę i u których wykazano, że nie są w stanie stosować wziewnych kortykosteroidów.
- MONTEGEN zapobiega również zwężeniu dróg oddechowych wywołanym wysiłkiem
Lekarz określi sposób stosowania leku MONTEGEN w zależności od objawów i nasilenia astmy.
Co to jest astma?
Astma jest chorobą przewlekłą.
Astma obejmuje:
- Trudności w oddychaniu z powodu zwężenia dróg oddechowych. Zwężenie dróg oddechowych pogarsza się i poprawia w odpowiedzi na różne warunki.
- Drogi oddechowe, które reagują na wiele drażniących bodźców, takich jak dym papierosowy, pyłki, zimne powietrze lub ćwiczenia.
- Obrzęk (stan zapalny) dróg oddechowych.
Objawy astmy to: kaszel, duszność i ucisk w klatce piersiowej.
Przeciwwskazania Kiedy nie należy stosować preparatu Montegen
Poinformuj swojego lekarza o jakiejkolwiek aktualnej lub przebytej chorobie oraz wszelkich alergiach.
Nie należy przyjmować leku MONTEGEN, jeśli Ty lub Twoje dziecko
- jeśli pacjent ma uczulenie (nadwrażliwość) na montelukast lub którykolwiek z pozostałych składników leku MONTEGEN (patrz 6. INNE INFORMACJE).
Środki ostrożności dotyczące stosowania Informacje ważne przed zastosowaniem leku Montegen
Zachowaj szczególną ostrożność z MONTEGEN
- w przypadku nasilenia się astmy lub oddychania należy natychmiast skontaktować się z lekarzem.
- MONTEGEN doustnie nie powinien być stosowany w leczeniu ostrych ataków astmy. Jeśli wystąpią drgawki, postępuj zgodnie z instrukcjami lekarza. Zawsze miej przy sobie awaryjne leki wziewne na ataki astmy.
- Ważne jest, abyś Ty lub Twoje dziecko przyjmowali wszystkie leki na astmę przepisane przez lekarza. MONTEGEN nie powinien być stosowany zamiast innych leków przeciwastmatycznych, które lekarz przepisał Tobie lub Twojemu dziecku.
- Pacjenci przyjmujący leki przeciwastmatyczne powinni mieć świadomość, że jeśli wystąpią u nich objawy, takie jak zespół grypopodobny, mrowienie lub osłabienie czucia w rękach lub nogach, pogorszenie objawów płucnych i/lub zaczerwienienie skóry, lekarz.
- Nie należy przyjmować kwasu acetylosalicylowego (aspiryny) ani leków przeciwzapalnych (zwanych również niesteroidowymi lekami przeciwzapalnymi lub NLPZ), jeśli pogarszają one astmę.
Używaj u dzieci
Dla dzieci w wieku od 2 do 5 lat dostępne są tabletki do żucia MONTEGEN 4 mg i granulat 4 mg.
Dla dzieci w wieku od 6 do 14 lat dostępne są tabletki do żucia MONTEGEN 5 mg.
Interakcje Jakie leki lub pokarmy mogą modyfikować działanie Montegen
Stosowanie MONTEGEN z innymi lekami
Niektóre leki mogą zakłócać działanie leku MONTEGEN lub MONTEGEN może zakłócać działanie innych leków.
Należy poinformować lekarza, jeśli pacjent przyjmuje lub ostatnio przyjmował jakiekolwiek inne leki, nawet te bez recepty.
Przed rozpoczęciem stosowania leku MONTEGEN należy powiedzieć lekarzowi o przyjmowaniu następujących leków:
- Fenobarbital (stosowany w leczeniu padaczki)
- Fenytoina (stosowana w leczeniu padaczki)
- Ryfampicyna (stosowana w leczeniu gruźlicy i niektórych innych zakażeń)
Stosowanie MONTEGEN z jedzeniem i piciem
Tabletki do żucia MONTEGEN 5 mg nie powinny być przyjmowane bezpośrednio przed lub po posiłku; należy go przyjmować co najmniej 1 godzinę przed lub 2 godziny po posiłku.
Ostrzeżenia Ważne jest, aby wiedzieć, że:
Ciąża i karmienie piersią
Stosuj w ciąży
Jeśli jesteś w ciąży lub chcesz zajść w ciążę, przed zażyciem leku MONTEGEN należy skonsultować się z lekarzem. Lekarz określi, czy w takich okolicznościach można lub nie można przyjmować leku MONTEGEN.
Stosuj podczas karmienia piersią
Nie wiadomo, czy MONTEGEN może pojawiać się w mleku ludzkim. Jeśli pacjentka karmi piersią lub planuje karmić piersią, przed zastosowaniem leku MONTEGEN powinna skonsultować się z lekarzem.
Prowadzenie i używanie maszyn
Nie oczekuje się wpływu na zdolność prowadzenia pojazdów i obsługiwania maszyn. Jednak indywidualne reakcje na leki mogą się różnić. Niektóre działania niepożądane (takie jak zawroty głowy i senność), które były bardzo rzadko zgłaszane podczas stosowania leku MONTEGEN, mogą wpływać na zdolność prowadzenia pojazdów i obsługiwania maszyn.
Ważne informacje o niektórych składnikach MONTEGEN
Tabletki do żucia MONTEGEN zawierają aspartam, źródło fenyloalaniny. Jeśli dziecko ma fenyloketonurię (rzadkie dziedziczne zaburzenie metabolizmu), należy pamiętać, że każda tabletka do żucia 5 mg zawiera fenyloalaninę (co odpowiada 0,842 mg fenyloalaniny na 5 mg tabletkę do żucia).
Dawka, sposób i czas podawania Jak stosować Montegen: dawkowanie
- Ty lub Twoje dziecko powinniście przyjmować tylko jedną tabletkę MONTEGEN dziennie zgodnie z zaleceniami lekarza.
- Tabletkę należy również zażywać, jeśli u pacjenta lub dziecka nie występują żadne objawy lub wystąpił ostry atak astmy.
- MONTEGEN należy zawsze stosować zgodnie z zaleceniami lekarza. W razie wątpliwości należy skonsultować się z lekarzem lub farmaceutą.
- Tabletkę należy przyjmować doustnie.
Dla dzieci od 6 do 14 lat
Jedna tabletka do rozgryzania i żucia 5 mg codziennie wieczorem. Tabletki do żucia MONTEGEN 5 mg nie powinny być przyjmowane bezpośrednio przed lub po posiłku. Należy go przyjmować co najmniej 1 godzinę przed lub 2 godziny po posiłku.
Jeśli Ty lub Twoje dziecko przyjmujecie MONTEGEN, upewnij się, że nie przyjmujesz żadnych innych produktów zawierających tę samą substancję czynną, montelukast.
Przedawkowanie Co zrobić w przypadku przyjęcia zbyt dużej dawki leku Montegen
Jeśli Ty lub Twoje dziecko zażyjesz więcej leku MONTEGEN niż powinieneś
Natychmiast skonsultuj się z lekarzem.
W większości zgłoszeń przedawkowania nie stwierdzono działań niepożądanych. Najczęściej zgłaszanymi objawami przedawkowania u dorosłych i dzieci są ból brzucha, senność, pragnienie, ból głowy, wymioty i nadpobudliwość.
Pominięcie przyjęcia leku MONTEGEN lub podania go dziecku
Staraj się przyjmować MONTEGEN zgodnie z zaleceniami. Jeśli jednak Ty lub Twoje dziecko zapomnisz o zażyciu tabletki, kontynuuj przyjmowanie leku w zwykłej dawce. Nie należy stosować dawki podwójnej w celu uzupełnienia pominiętej tabletki.
Przerwanie stosowania leku MONTEGEN . przez Ciebie lub Twoje dziecko
Leczenie lekiem MONTEGEN może być skuteczne w leczeniu astmy tylko wtedy, gdy Ty lub Twoje dziecko nadal go przyjmujesz.Ważne jest, aby kontynuować przyjmowanie leku MONTEGEN tak długo, jak zaleci to lekarz.Pomoże to kontrolować astmę u Twojego dziecka.
W przypadku dalszych pytań dotyczących stosowania leku MONTEGEN należy zwrócić się do lekarza lub farmaceuty
Skutki uboczne Jakie są skutki uboczne Montegen
Jak każdy lek, MONTEGEN może powodować działania niepożądane, chociaż nie u każdego one wystąpią.
W badaniach klinicznych tabletek do rozgryzania i żucia MONTEGEN 5 mg najczęściej zgłaszanymi działaniami niepożądanymi uważanymi za związane z preparatem MONTEGEN (występującymi u co najmniej 1 na 100 pacjentów i u mniej niż 1 na 10 pacjentów) były:
- Bół głowy
Ponadto w badaniach klinicznych dotyczących tabletek powlekanych MONTEGEN 10 mg zgłaszano następujące działania niepożądane:
- Ból brzucha.
Te działania niepożądane były zwykle łagodne i występowały częściej u pacjentów leczonych preparatem MONTEGEN niż u pacjentów otrzymujących placebo (tabletki niezawierające substancji leczniczej).
Częstość występowania możliwych działań niepożądanych wymienionych poniżej jest zdefiniowana przy użyciu następującej konwencji:
Bardzo często (dotyczy co najmniej 1 użytkownika na 10)
Często (dotyczy 1 do 10 użytkowników na 100)
Niezbyt często (dotyczy 1 do 10 użytkowników na 1000)
Rzadko (dotyczy od 1 do 10 użytkowników na 10 000)
Bardzo rzadko (dotyczy mniej niż 1 użytkownika na 10 000)
Ponadto zgłaszano następujące działania niepożądane związane z komercyjnym stosowaniem leku:
- infekcja górnych dróg oddechowych (bardzo często)
- zwiększona skłonność do krwawień (rzadko)
- reakcje alergiczne, w tym obrzęk twarzy, warg, języka i (lub) gardła, który może powodować trudności w oddychaniu lub połykaniu (niezbyt często)
- zmiany zachowania i nastroju [zmiany snów, w tym koszmary senne, bezsenność, lunatykowanie, drażliwość, uczucie lęku, niepokoju, pobudzenie, w tym zachowanie agresywne lub wrogość, depresja (Niezbyt często); drżenie, zaburzenia uwagi, zaburzenia pamięci (Rzadko); halucynacje, dezorientacja, myśli i działania samobójcze (bardzo rzadko)]
- zawroty głowy, senność, mrowienie, drgawki (Niezbyt często)
- kołatanie serca (rzadko)
- krwawienie z nosa (niezbyt często)
- biegunka, nudności, wymioty (Często); suchość w ustach, zaburzenia trawienia (niezbyt często)
- zapalenie wątroby (zapalenie wątroby) (bardzo rzadko)
- wysypka (często); siniaki, świąd, pokrzywka (Niezbyt często), czerwony bolesny obrzęk tkanki podskórnej najczęściej zlokalizowany na przedniej powierzchni nóg (rumień guzowaty), ciężkie reakcje skórne (rumień wielopostaciowy), które mogą wystąpić bez ostrzeżenia (Bardzo rzadko)
- ból stawów lub mięśni, skurcze mięśni (niezbyt często)
- gorączka (wspólna); osłabienie / uczucie zmęczenia, złe samopoczucie, obrzęk (Niezbyt często)
Podczas leczenia montelukastem pacjentów z astmą w bardzo rzadkich przypadkach zgłaszano zespół objawów, takich jak postać grypopodobna, mrowienie lub drętwienie rąk lub nóg, nasilenie objawów płucnych i (lub) wysypka skórna. . Pacjent powinien natychmiast zgłosić się do lekarza, jeśli wystąpi jeden lub więcej z tych objawów.
Zapytaj swojego lekarza lub farmaceutę o więcej informacji na temat skutków ubocznych. Należy zgłosić lekarzowi lub farmaceucie wszelkie działania niepożądane inne niż wymienione powyżej lub w przypadku nasilenia się jakichkolwiek objawów.
Wygaśnięcie i przechowywanie
- MONTEGEN należy przechowywać w miejscu niedostępnym i niewidocznym dla dzieci.
- Nie stosować leku MONTEGEN po upływie terminu ważności podanego na etykiecie z sześcioma cyframi po EXP. Pierwsze dwie cyfry oznaczają miesiąc; ostatnie cztery cyfry oznaczają rok.Termin ważności oznacza ostatni dzień miesiąca.
- Przechowywać w oryginalnym opakowaniu, aby chronić go przed światłem i wilgocią.
- Leków nie należy wyrzucać do kanalizacji ani domowych pojemników na odpadki. Należy zapytać farmaceutę, jak usunąć leki, których się już nie używa, co pomoże chronić środowisko.
Skład i postać farmaceutyczna
Co zawiera MONTEGEN
- Substancją czynną jest montelukast. Każda tabletka zawiera montelukast sodowy, co odpowiada 5 mg montelukastu.
- Pozostałe składniki to: Mannitol, celuloza mikrokrystaliczna, hyproloza (E463), czerwony tlenek żelaza (E172), kroskarmeloza sodowa, aromat wiśniowy, aspartam (E951) i magnezu stearynian.
Opis wyglądu MONTEGEN i zawartości opakowania
Różowe, okrągłe, dwuwypukłe, z nadrukiem 275 z jednej strony.
Opakowania blistrowe po: 7, 10, 14, 20, 28, 30, 49, 50, 56, 84, 90, 98, 100, 140, 200 tabletek.
Blistry (jednodawkowe), w opakowaniach po: 49, 50 i 56 tabletek.
Nie wszystkie rozmiary opakowań mogą być wprowadzone na rynek.
Ulotka pakietu źródłowego: AIFA (Włoska Agencja Leków). Treść opublikowana w styczniu 2016 r. Przedstawione informacje mogą być nieaktualne.
Aby mieć dostęp do najbardziej aktualnej wersji, warto wejść na stronę AIFA (Włoskiej Agencji Leków). Zastrzeżenie i przydatne informacje.
01.0 NAZWA PRODUKTU LECZNICZEGO
MONTEGEN 5 MG TABLETEK DO ŻUCIA
02.0 SKŁAD JAKOŚCIOWY I ILOŚCIOWY
Jedna tabletka do żucia zawiera: montelukast sodowy, co odpowiada 5 mg montelukastu.
Substancja pomocnicza o znanym działaniu: Jedna tabletka leku zawiera 1,5 mg aspartamu (E 951).
Pełny wykaz substancji pomocniczych, patrz punkt 6.1.
03.0 POSTAĆ FARMACEUTYCZNA
Tabletka do żucia.
Różowa, okrągła, dwustronnie wypukła, o średnicy 9,5 mm, z nadrukiem 275 z jednej strony.
04.0 INFORMACJE KLINICZNE
04.1 Wskazania terapeutyczne
Montegen jest wskazany w leczeniu astmy jako terapia wspomagająca u pacjentów z przewlekłą łagodną/umiarkowaną astmą, których nie można kontrolować za pomocą wziewnych kortykosteroidów i u których jednocześnie stosuje się krótko działających agonistów receptorów beta-adrenergicznych. należy zapewnić niewystarczającą kontrolę kliniczną astmy.
Montegen może być również alternatywną opcją leczenia w stosunku do wziewnych kortykosteroidów w małych dawkach u pacjentów z przewlekłą łagodną astmą, u których w ostatnim czasie nie występowały ciężkie napady astmy wymagające doustnych kortykosteroidów i którzy nie mogą stosować wziewnych kortykosteroidów (patrz punkt 4.2).
Montegen jest również wskazany w profilaktyce astmy, w której dominującym elementem jest skurcz oskrzeli wywołany wysiłkiem fizycznym.
04.2 Dawkowanie i sposób podawania
Dawkowanie
Zalecana dawka dla dzieci w wieku od 6 do 14 lat to jedna tabletka do żucia 5 mg na dobę, przyjmowana wieczorem. W przypadku przyjmowania z posiłkiem, preparat Montegen należy przyjmować 1 godzinę przed posiłkiem lub 2 godziny po posiłku. W tej grupie wiekowej nie jest konieczne dostosowanie dawki.
Zalecenia ogólne
Efekt terapeutyczny Montegena na parametry kontroli astmy staje się widoczny w ciągu jednego dnia.Poradzić pacjentowi, aby kontynuował przyjmowanie leku Montegen nawet wtedy, gdy astma jest pod kontrolą, a także w okresach nasilenia astmy.
Nie ma konieczności dostosowania dawki u pacjentów z niewydolnością nerek lub łagodnymi do umiarkowanych zaburzeniami czynności wątroby. Brak danych dotyczących pacjentów z ciężkimi zaburzeniami czynności wątroby. Dawka jest taka sama dla pacjentów obu płci.
Montegen jako alternatywa leczenia małych dawek kortykosteroidów wziewnych w łagodnej przewlekłej astmie
Nie zaleca się stosowania montelukastu w monoterapii u pacjentów z umiarkowaną przewlekłą astmą.Stosowanie montelukastu jako alternatywnej opcji leczenia w stosunku do małych dawek kortykosteroidów wziewnych u dzieci z łagodną przewlekłą astmą należy rozważać tylko u tych pacjentów, którzy nie mają niedawna historia ciężkich napadów astmy wymagających doustnych kortykosteroidów, u których wykazano, że nie są w stanie stosować wziewnych kortykosteroidów (patrz punkt 4.1). Przetrwałą łagodną astmę definiuje się jako objawy astmy występujące częściej niż raz w tygodniu, ale rzadziej niż raz dziennie oraz objawy nocne, które występują częściej niż dwa razy w miesiącu, ale rzadziej niż raz w tygodniu. Czynność płuc między epizodami jest prawidłowa. Jeśli podczas obserwacji nie uzyska się zadowalającej kontroli astmy (zwykle w ciągu miesiąca), należy rozważyć konieczność zastosowania dodatkowego lub innego leczenia przeciwzapalnego, w oparciu o stopniowe podejście do leczenia astmy. .
Terapia Montegen w związku z innymi metodami leczenia astmy
Gdy leczenie preparatem Montegen jest stosowane jako terapia uzupełniająca do kortykosteroidów wziewnych, nie należy gwałtownie zastępować kortykosteroidów wziewnych preparatem Montegen (patrz punkt 4.4).
Tabletki 10 mg są dostępne dla dorosłych i młodzieży w wieku 15 lat i starszych.
Populacja pediatryczna
Nie należy podawać leku Montegen 5 mg tabletek do żucia dzieciom w wieku poniżej 6 lat. Bezpieczeństwo i skuteczność tabletek do rozgryzania i żucia Montegen 5 mg u dzieci w wieku poniżej 6 lat nie zostały ustalone.
Tabletki do żucia 4 mg są dostępne dla dzieci w wieku od 2 do 5 lat.
Jest dostępny w granulkach 4 mg dla dzieci w wieku od 6 miesięcy do 5 lat.
Sposób podawania
Stosowanie doustne.
Tabletki należy żuć przed połknięciem.
Tabletki należy żuć przed połknięciem.
04.3 Przeciwwskazania
Nadwrażliwość na substancję czynną lub na którąkolwiek substancję pomocniczą wymienioną w punkcie 6.1.
04.4 Specjalne ostrzeżenia i odpowiednie środki ostrożności dotyczące stosowania
Poradzić pacjentowi, aby nie stosował montelukastu doustnie w leczeniu ostrych napadów astmy i miał pod ręką odpowiednie leki ratunkowe powszechnie stosowane w takich stanach. W przypadku ostrego napadu należy jak najszybciej zgłosić się do lekarza prowadzącego krótko działający wziewny agonista receptorów beta-adrenergicznych.
Montelukastu nie należy gwałtownie zastępować kortykosteroidami wziewnymi lub doustnymi.
Brak danych wskazujących, że doustną dawkę kortykosteroidów można zmniejszyć przez jednoczesne podawanie montelukastu.
W rzadkich przypadkach u pacjentów przyjmujących leki przeciwastmatyczne, w tym montelukast, może wystąpić ogólnoustrojowa eozynofilia, czasami objawiająca się klinicznymi objawami zapalenia naczyń podobnymi do zespołu Churga-Straussa, stan często leczony ogólnoustrojowo kortykosteroidami. Przypadki te były czasami związane ze zmniejszeniem lub przerwaniem leczenia doustnymi kortykosteroidami.Chociaż nie ustalono związku przyczynowego z antagonizmem receptorów leukotrienowych, lekarze powinni monitorować pacjentów pod kątem wystąpienia eozynofilii, wysypki naczyniowej, nasilenia objawów płucnych, powikłań sercowych i / lub neuropatia. Pacjenci, u których wystąpią te objawy, muszą zostać zbadani, a ich schematy leczenia ponownie rozważone.
U pacjentów z astmą wrażliwą na aspirynę leczenie montelukastem nie zmienia potrzeby unikania aspiryny lub innych niesteroidowych leków przeciwzapalnych.
Montegen zawiera aspartam, źródło fenyloalaniny. Pacjenci z fenyloketonurią powinni być świadomi, że każda tabletka do żucia 5 mg zawiera fenyloalaninę w ilości odpowiadającej 0,842 mg na dawkę.
04.5 Interakcje z innymi produktami leczniczymi i inne formy interakcji
Montelukast może być podawany z innymi lekami powszechnie stosowanymi w profilaktyce i przewlekłym leczeniu astmy.W badaniach interakcji leków zalecana dawka kliniczna montelukastu nie miała klinicznie istotnego wpływu na farmakokinetykę następujących leków: teofilina, prednizon, prednizolon, środki antykoncepcyjne doustnie (etynyloestradiol/noretyndron 35/1), terfenadyna, digoksyna i warfaryna.
Pole pod krzywą stężenia w osoczu (AUC) montelukastu zmniejszyło się o około 40% u pacjentów otrzymujących jednocześnie fenobarbital Ponieważ montelukast jest metabolizowany przez CYP 3A4, 2C8 i 2C9, należy zachować ostrożność, szczególnie u dzieci. CYP 3A4, 2C8 i 2C9, takich jak fenytoina, fenobarbital i ryfampicyna.
Edukacja in vitro wykazali, że montelukast jest silnym inhibitorem CYP 2C8. Jednak dane z klinicznego badania interakcji z montelukastem i rozyglitazonem (substratem stosowanym jako reprezentatywny test dla produktów leczniczych metabolizowanych głównie przez CYP 2C8) wykazały, że montelukast nie hamuje CYP 2C8. in vivo. Dlatego nie oczekuje się, aby montelukast znacząco zmieniał metabolizm produktów leczniczych metabolizowanych przez ten enzym (np. paklitaksel, rozyglitazon i repaglinid).
Edukacja in vitro wykazali, że montelukast jest substratem CYP 2C8 oraz w mniejszym stopniu 2C9 i 3A4. W badaniu interakcji między lekami montelukastu i gemfibrozylu (inhibitor zarówno CYP 2C8, jak i 2C9) gemfibrozyl zwiększał ekspozycję ogólnoustrojową na montelukast 4,4-krotnie. inhibitorów 2C8, ale lekarz powinien być świadomy możliwości nasilenia działań niepożądanych.
Na podstawie danych in vitro, nie oczekuje się klinicznie istotnych interakcji z słabszymi inhibitorami CYP2C8 (np. trimetoprim). Jednoczesne podawanie montelukastu z itrakonazolem, silnym inhibitorem CYP 3A4, nie powodowało istotnego zwiększenia ogólnoustrojowej ekspozycji na montelukast.
04.6 Ciąża i laktacja
Ciąża
Badania na zwierzętach nie wykazują szkodliwego wpływu na przebieg ciąży lub rozwój zarodka i płodu.
Ograniczone dane dostępne w bazach danych dotyczących ciąży nie wskazują na istnienie związku przyczynowego między Montegen a wadami rozwojowymi (wadami kończyn) rzadko zgłaszanymi po wprowadzeniu produktu do obrotu na całym świecie.
Montegen można stosować w ciąży tylko wtedy, gdy jest to wyraźnie uznane za niezbędne.
Czas karmienia
Badania na szczurach wykazały, że montelukast przenika do mleka matki (patrz punkt 5.3). Nie wiadomo, czy montelukast/metabolity przenikają do mleka ludzkiego.
Montegen może być stosowany podczas karmienia piersią tylko wtedy, gdy jest to wyraźnie konieczne.
04.7 Wpływ na zdolność prowadzenia pojazdów i obsługiwania maszyn
Montegen nie ma wpływu lub ma nieistotny wpływ na zdolność prowadzenia pojazdów i obsługiwania maszyn, jednak niektórzy pacjenci zgłaszali senność lub zawroty głowy.
04.8 Działania niepożądane
Montelukast oceniano w następujących badaniach klinicznych:
• tabletki powlekane 10 mg u około 4000 dorosłych i młodzieży w wieku ≥ 15 lat.
• tabletki do żucia 5 mg u około 1750 dzieci w wieku od 6 do 14 lat.
Często zgłaszano następujące działania niepożądane związane z lekiem (≥1/100,
W przypadku kontynuowania leczenia w badaniach klinicznych przez okres do 2 lat u ograniczonej liczby pacjentów dorosłych i do 12 miesięcy u dzieci w wieku od 6 do 14 lat profil bezpieczeństwa nie uległ zmianie.
Tabela działań niepożądanych
Działania niepożądane zgłaszane po wprowadzeniu produktu do obrotu są wymienione w poniższej tabeli według klasyfikacji układów i narządów oraz określonych działań niepożądanych.Kategorie częstości oszacowano na podstawie odpowiednich badań klinicznych.
Zgłaszanie podejrzewanych działań niepożądanych
Zgłaszanie podejrzewanych działań niepożądanych występujących po dopuszczeniu produktu leczniczego do obrotu jest ważne, ponieważ umożliwia ciągłe monitorowanie stosunku korzyści do ryzyka produktu leczniczego. Osoby należące do fachowego personelu medycznego są proszone o zgłaszanie wszelkich podejrzewanych działań niepożądanych za pośrednictwem krajowego systemu zgłaszania. „adres https: //www.aifa.gov.it/content/segnalazioni-reazioni-avverse.
04.9 Przedawkowanie
W badaniach dotyczących przewlekłej astmy montelukast podawano dorosłym pacjentom w dawkach do 200 mg/dobę przez 22 tygodnie, aw badaniach krótkoterminowych do 900 mg/dobę przez około tydzień, bez klinicznie istotnych działań niepożądanych.
Istnieją doniesienia o ostrym przedawkowaniu montelukastu po wprowadzeniu produktu do obrotu oraz w badaniach klinicznych, w tym doniesienia o dawkach do 1000 mg u dorosłych i dzieci (około 61 mg/kg u 42-miesięcznego dziecka). zgodne z profilem bezpieczeństwa u dorosłych i dzieci W większości przypadków przedawkowania nie wystąpiły żadne działania niepożądane.
Objawy przedawkowania
Najczęściej obserwowane działania niepożądane były zgodne z profilem bezpieczeństwa montelukastu i obejmowały ból brzucha, senność, pragnienie, ból głowy, wymioty i nadpobudliwość psychoruchową.
Postępowanie w przypadku przedawkowania
Brak szczegółowych informacji dotyczących leczenia przedawkowania montelukastu. Nie wiadomo, czy montelukast można dializować za pomocą dializy otrzewnowej lub hemodializy.
05.0 WŁAŚCIWOŚCI FARMAKOLOGICZNE
05.1 Właściwości farmakodynamiczne
Grupa farmakoterapeutyczna: antagoniści receptora leukotrienowego, kod ATC: R03D C03
Mechanizm akcji
Leukotrieny cysteinylowe (LTC4, LTD4, LTE4) są silnymi zapalnymi eikozanoidami uwalnianymi przez różne komórki, w tym komórki tuczne i eozynofile. Te ważne mediatory astmy wiążą się z receptorami cysteinylowo-leukotrienowymi (CysLT), występującymi u ludzi w drogach oddechowych i powodują różne działania na drogi oddechowe, w tym zwężenie oskrzeli, wydzielanie śluzówki, przepuszczalność naczyń i rekrutację eozynofili.
Efekty farmakodynamiczne
Montelukast jest związkiem aktywnym po podaniu doustnym, który wiąże się z wysokim powinowactwem i selektywnością z receptorem CysLT1. W badaniach klinicznych montelukast w małych dawkach, takich jak 5 mg, hamuje skurcz oskrzeli spowodowany inhalacją LTD 4. Rozszerzenie oskrzeli obserwowano w ciągu dwóch godzin po podaniu doustnym. Leczenie montelukastem hamowało zarówno wczesne, jak i późne stadia skurczu oskrzeli spowodowane „ekspozycja na” antygen. Montelukast, w porównaniu z placebo, zmniejszał liczbę eozynofili we krwi obwodowej zarówno u pacjentów dorosłych, jak iu dzieci. W odrębnym badaniu leczenie montelukastem istotnie zmniejszyło liczbę eozynofili w drogach oddechowych (w wyniku badania plwociny) i krwi obwodowej, poprawiając jednocześnie kliniczną kontrolę astmy.
Skuteczność kliniczna i bezpieczeństwo
W badaniach u dorosłych w porównaniu z placebo wykazano, że montelukast w dawce 10 mg raz na dobę znacząco poprawiał FEV1 rano (zmiana w stosunku do wartości wyjściowej 10,4%). vs 2,7%), szczytowy przepływ wydechowy (PEFR) w stosunku do wartości wyjściowej 24,5 l/min vs 3,3 l/min) i istotnie zmniejsza łączne stosowanie agonistów receptorów b-adrenergicznych (zmiany od wartości wyjściowych -26,1% vs -4,6%). Zgłaszana przez pacjentów poprawa w zakresie oceny objawów w ciągu dnia i nocy była znacznie lepsza niż w grupie placebo.
W badaniach z udziałem dorosłych wykazano, że montelukast wywiera addytywne działanie kliniczne do wywołanego przez kortykosteroid wziewny (zmiany procentowe w stosunku do wartości wyjściowych dla beklometazonu wziewnego z montelukastem vs beklometazon FEV1 odpowiednio: 5,43% vs 1,04% oraz stosowanie agonistów beta-adrenergicznych: -8,70% vs -2,64%). Wykazano, że początkowa odpowiedź na montelukast była szybsza niż na wziewny beklometazon (200 mg dwa razy na dobę, podawany za pomocą przekładki), chociaż beklometazon wykazywał przez cały dwunastotygodniowy okres badania. montelukast vs beklometazon FEV1 odpowiednio: 7,49% vs 13,3% oraz stosowanie agonistów beta-adrenergicznych: -28,28% vs -43,89%). Jednak „wysoki odsetek pacjentów leczonych montelukastem osiągnął odpowiedź kliniczną podobną do tej obserwowanej w przypadku beklometazonu (np. 50% pacjentów leczonych beklometazonem osiągnęło poprawę FEV1 o około 11% lub więcej niż na początku, podczas gdy około 42% pacjentów leczonych montelukastem uzyskało taką samą odpowiedź).
W 8-tygodniowym badaniu z udziałem dzieci i młodzieży w wieku 6-14 lat montelukast w dawce 5 mg raz na dobę znacząco poprawił czynność oddechową w porównaniu z placebo (odsetek zmian FEV1 w stosunku do wartości początkowej: 8,71% vs 4,16%; zmiany procentowe w stosunku do wartości wyjściowej w porannym PEFR 27,9 l/min vs 17,8 l/min) i zmniejszono „w miarę potrzeb” stosowanie agonistów receptorów b-adrenergicznych (zmiany w stosunku do wartości wyjściowej -11,7% vs +8,2 %).
W 12-miesięcznym badaniu porównawczym skuteczności montelukastu i wziewnego flutykazonu w kontroli astmy u dzieci w wieku od 6 do 14 lat z przewlekłą łagodną astmą, montelukast nie był gorszy niż flutykazon pod względem zwiększania odsetka dni bez konieczności leczenia ratunkowego ( RFD), główny punkt końcowy. Średni odsetek RFD w 12-miesięcznym okresie leczenia wzrósł z 61,6 do 84,0 w grupie montelukastu i z 60,9 do 86,7 w grupie flutykazonu.Różnica między grupami w średnim zwiększeniu odsetka RFD w skali najmniejszych kwadratów (LS) była statystycznie istotna (-2,8 przy 95% CI -4,7, -0,9), ale mieściła się w predefiniowanej granicy równoważności z punktu klinicznego pogląd.
Zarówno montelukast, jak i flutikazon poprawiły również kontrolę astmy na podstawie zmiennych drugorzędowych ocenianych w ciągu 12-miesięcznego okresu leczenia: FEV1 wzrósł z 1,83 do 2,09 w grupie montelukastu i z 1,85 do 2,14 l. w grupie flutykazonu. w FEV1 między grupami wynosił -0,02 l., z 95% CI -0,06, 0,02. Oczekiwany wzrost FEV1 w stosunku do wartości wyjściowej wyniósł 0,6% w grupie montelukastu i 2,7% w grupie flutykazonu.Różnica między średnią LS dla zmiany procentu przewidywanego FEV1 w stosunku do wartości wyjściowej była istotna: -2,2%, przy 95% CI -3,6, -0,7.
Odsetek dni, w których stosowano β-agonistę zmniejszył się z 38,0 do 15,4 w grupie montelukastu oraz z 38,5 do 12,8 w grupie flutikazonu. Różnica między grupami w średnich LS odsetka dni z użyciem beta-mimetyku była istotna: 2,7 przy 95% CI 0,9, 4,5.
Odsetek pacjentów z atakiem astmy (definiowanym jako okres pogorszenia astmy, który wymaga leczenia steroidami) per os, nieplanowana wizyta lekarska, wizyta na oddziale ratunkowym lub hospitalizacja) wyniosła 32,2 w grupie montelukastu i 25,6 w grupie flutykazonu; iloraz szans (95% CI) był istotny: 1,38.
Odsetek pacjentów stosujących ogólnoustrojowo (głównie doustnie) kortykosteroidy w trakcie badania wyniósł 17,8% w grupie montelukastu i 10,5% w grupie flutykazonu. Różnica w średnich LS między grupami była istotna: 7,3% z 95% CI 2,9, 11,7.
Znaczące zmniejszenie skurczu oskrzeli wywołanego wysiłkiem fizycznym (BIE) wykazano w 12-tygodniowym badaniu z udziałem dorosłych (maksymalne zmniejszenie FEV1: 22,33% dla montelukastu vs 32,40% dla placebo; 5% czas powrotu do wartości wyjściowej FEV1: 44,22 min vs 60,64 min). Efekt ten był stały przez cały 12-tygodniowy czas trwania badania. Zmniejszenie BIE wykazano również w krótkoterminowym badaniu z udziałem dzieci (maksymalne zmniejszenie FEV1: 18,27% vs 26,11%; 5% czas powrotu do wartości wyjściowej FEV1: 17,76 min vs 27,98 min). W obu badaniach efekt wykazano pod koniec przerwy w dawkowaniu raz na dobę.
U pacjentów z astmą wrażliwą na aspirynę otrzymujących jednocześnie kortykosteroidy wziewne i (lub) doustne, leczenie montelukastem w porównaniu z placebo powodowało znaczącą poprawę kontroli astmy (odsetek zmian FEV1 w stosunku do wartości wyjściowej: 8,55% vs -1,74%; zmniejszenie całkowitego wykorzystania agonistów receptorów beta-adrenergicznych w porównaniu do wartości wyjściowych: -27,78% vs 2,09%).
05.2 „Właściwości farmakokinetyczne
Wchłanianie
Montelukast jest szybko wchłaniany po podaniu doustnym. W przypadku tabletek powlekanych 10 mg średnia wartość maksymalnego stężenia w osoczu (Cmax) u dorosłych osiągana jest po 3 godzinach (Tmax) po podaniu na czczo.Średnia biodostępność po podaniu doustnym wynosi 64%.Biodostępność i Cmax po podaniu doustnym nie ma wpływu na standardowy posiłek Bezpieczeństwo i skuteczność wykazano w badaniach klinicznych, w których tabletki powlekane 10 mg podawano niezależnie od harmonogramu przyjmowania pokarmów.
W przypadku tabletek do rozgryzania i żucia 5 mg wartość Cmax dla dorosłych osiągana jest po 2 godzinach stosowania na czczo.Średnia biodostępność po podaniu doustnym wynosi 73% i zmniejsza się do 63% w przypadku standardowego posiłku.
Dystrybucja
Ponad 99% montelukastu wiąże się z białkami osocza. Objętość dystrybucji montelukastu w stanie stacjonarnym wynosi średnio 8-11 litrów. Badania na szczurach z radioznakowanym montelukastem wskazują na minimalną dystrybucję przez barierę krew-mózg. Ponadto, 24 godziny po podaniu dawki, stężenia radioznakowanej substancji były minimalne we wszystkich innych tkankach.
Biotransformacja
Montelukast jest intensywnie metabolizowany. W badaniach przeprowadzonych z zastosowaniem dawek terapeutycznych stężenie metabolitów montelukastu w osoczu było niewykrywalne w stanie stacjonarnym zarówno u dorosłych, jak iu dzieci.
Cytochrom P450 2C8 jest głównym enzymem w metabolizmie montelukastu.Ponadto CYP 3A4 i 2C9 mogą mieć niewielki udział, chociaż wykazano, że itrakonazol, inhibitor CYP 3A4, nie zmienia parametrów farmakokinetycznych montelukastu u zdrowych osób. którzy otrzymywali 10 mg montelukastu dziennie.
Na podstawie wyników in vitro na mikrosomach wątroby ludzkiej montelukast, w stężeniach terapeutycznych w osoczu, nie hamuje cytochromów P450 3A4, 2C9, 1A2, 2A6, 2C19 ani 2D6. Udział metabolitów w działaniu terapeutycznym montelukastu jest minimalny.
Eliminacja
U zdrowej osoby dorosłej klirens osoczowy montelukastu wynosi średnio 45 ml / min. Po podaniu doustnym dawki montelukastu znakowanego radioizotopem, 86% radioaktywności wykryto w badaniu kału przeprowadzanym przez pięć dni, a mniej niż 0,2% wykryto w mocz Dane te, wraz z danymi dotyczącymi biodostępności montelukastu po podaniu doustnym, wskazują, że montelukast i jego metabolity są wydalane prawie wyłącznie z żółcią.
Charakterystyka pacjentów
Nie ma konieczności dostosowania dawki u osób w podeszłym wieku lub pacjentów z łagodnymi lub umiarkowanymi zaburzeniami czynności wątroby. Nie przeprowadzono badań u pacjentów z niewydolnością nerek. Ponieważ montelukast i jego metabolity są wydalane głównie z żółcią, nie przewiduje się dostosowania dawki u pacjentów z niewydolnością nerek. Brak danych dotyczących farmakokinetyki montelukastu u pacjentów z ciężkimi zaburzeniami czynności wątroby (w skali Child-Pugh > 9).
Po podaniu dużych dawek montelukastu (20 i 60 razy większych od zalecanej dawki u ludzi) obserwowano zmniejszenie stężenia teofiliny w osoczu, czego nie obserwowano przy zalecanej dawce 10 mg raz na dobę.
05.3 Przedkliniczne dane o bezpieczeństwie
W badaniach toksyczności na zwierzętach obserwowano łagodne i przemijające zmiany biochemiczne SGPT (ALT), glukozy, fosforu i triglicerydów w surowicy.Objawami toksyczności u zwierzęcia były: zwiększone wydzielanie śliny, objawy żołądkowo-jelitowe, luźne stolce i zaburzenia równowagi elektrolitowej. Występowały one po dawkach, które zapewniały >17-krotność ekspozycji ogólnoustrojowej obserwowanej dla dawki klinicznej.U małp działania niepożądane występowały począwszy od dawek 150 mg/kg/dobę (>232-krotność ekspozycji ogólnoustrojowej obserwowanej dla dawki klinicznej). W badaniach na zwierzętach montelukast nie wpływał na płodność i zdolność rozrodczą przy ekspozycji ogólnoustrojowej 24 razy większej niż obserwowana po dawce klinicznej. W badaniu płodności samic szczurów zaobserwowano nieznaczny spadek masy ciała niemowląt po dawkach 200 mg/kg/dobę (>69-krotność ekspozycji ogólnoustrojowej obserwowanej po dawce klinicznej). grupa kontrolna przy ogólnoustrojowej ekspozycji 24 razy większej niż obserwowana po podaniu dawki klinicznej Nie zaobserwowano nieprawidłowości u szczurów Wykazano, że montelukast przenika przez barierę łożyskową i jest wydzielany z mlekiem kobiecym u zwierząt.
Po podaniu pojedynczej dawki doustnej montelukastu sodu do 5000 mg/kg, czyli maksymalnej badanej dawki (odpowiednio 15 000 mg/m2 i 30 000 mg/m2 u myszy i szczurów), nie doszło do zgonu myszy i szczurów. Dawka odpowiada 25 000-krotności zalecanej dawki dla ludzi u dorosłych (na podstawie masy ciała pacjenta dorosłego wynoszącej 50 kg).
Stwierdzono, że montelukast nie wykazuje fototoksyczności w zakresie promieniowania UVA, UVB ani widma widzialnego w dawkach do 500 mg/kg/dobę (około 200-krotność ekspozycji ogólnoustrojowej obserwowanej w przypadku dawki klinicznej) u myszy.
Montelukast nie był ani mutagenny, ani mutagenny u gryzonia in vitro oraz in vivo ani onkogenu.
06.0 INFORMACJE FARMACEUTYCZNE
06.1 Zaróbki
Mannitol
Celuloza mikrokrystaliczna
Hyproloza (E 463)
Czerwony tlenek żelaza (E 172)
Kroskarmeloza sodowa
Aromat wiśniowy
Aspartam (E 951)
Stearynian magnezu
06.2 Niezgodność
Nieistotne.
06.3 Okres ważności
2 lata.
06.4 Specjalne środki ostrożności przy przechowywaniu
Przechowywać w oryginalnym opakowaniu w celu ochrony przed światłem i wilgocią.
06.5 Rodzaj opakowania bezpośredniego i zawartość opakowania
Pakowane w blistry z poliamidu / PVC / aluminium w:
Blistry w opakowaniach po 7, 10, 14, 20, 28, 30, 50, 56, 84, 90, 98, 100, 140 i 200 tabletek.
Blistry (pojedyncza dawka), w opakowaniach po 49x1, 50x1 i 56x1 tabletek.
Nie wszystkie rozmiary opakowań mogą być wprowadzone na rynek.
06.6 Instrukcje użytkowania i obsługi
Niewykorzystany lek i odpady pochodzące z tego leku należy usunąć zgodnie z lokalnymi przepisami.
07.0 PODMIOT POZWOLENIA NA DOPUSZCZENIE DO OBROTU
NEOPHAMED GENTILI S.r.l.
Via San Giuseppe Cottolengo, 15 - 20143 Mediolan
08.0 NUMER POZWOLENIA NA DOPUSZCZENIE DO OBROTU
28 tabletek do żucia po 5 mg n.p. 034003020
09.0 DATA PIERWSZEGO ZEZWOLENIA LUB PRZEDŁUŻENIA ZEZWOLENIA
Data pierwszego zezwolenia: 20 sierpnia 1998 r.
Data ostatniego przedłużenia: 21 lipca 2008 r.
10.0 DATA ZMIAN TEKSTU
Luty 2016